Il glicogeno è un polimero ramificato di unità di D-glucosio e ha la funzione di deposito del monosaccaride, e dunque di energia.
Essendo sintetizzato senza ricorrere a uno stampo, a differenza delle proteine e degli acidi nucleici, si presenta come una popolazione di molecole con struttura chimica e dimensioni differenti.
Grazie alla sua struttura ramificata, il glicogeno è una molecola compatta e solubile, esercita una debole pressione osmotica, e permette un rapido rilascio del glucosio immagazzinato al momento del bisogno.
Al polimero di glucosio si associano proteine essenziali per il suo metabolismo, come la glicogenina (EC 2.4.1.186), la glicogeno sintasi (EC 2.4.1.11), la glicogeno fosforilasi (EC 2.4.1.1), l’enzima deramificante (EC 2.4.1.25 e EC 3.2.1.33), e altre che ne regolano l’ancoraggio con il citoscheletro e le membrane. Questi aggregati polisaccaride-proteine sono chiamati granuli beta e sono presenti nel citosol dei batteri, degli Archea, dei Funghi e delle cellule animali.
Inoltre, legati covalentemente allo scheletro polisaccaridico si trovano gruppi fosfato.
Proteine e gruppi fosfato sembrano essere coinvolti nella regolazione del suo metabolismo che, al pari del metabolismo in generale, si compone di due fasi: una fase costruttiva o anabolismo, e una fase degradativa o catabolismo. Nella fase costruttiva, reazioni catalizzate da specifici enzimi portano alla sintesi del glicogeno, mentre durante la fase degradativa, reazioni catalizzate da specifici enzimi portano alla sua degradazione o glicogenolisi.
Negli animali si trova praticamente in tutte le cellule, e, nei mammiferi è particolarmente abbondante nel fegato e nel muscolo scheletrico. Nel fegato diversi granuli beta si associano a formare strutture superiori dette granuli alfa.
Il glicogeno è presente anche nei lisosomi.
Nell’uomo rappresenta meno dell’1% delle riserve di energia ed è essenziale anche per il mantenimento dell’omeostasi glicemica.
È assente nelle piante, dove l’amido è la forma di conservazione del glucosio. La polimerizzazione del glucosio rappresenta quindi un meccanismo universale per immagazzinare energia.
Dal punto di vista nutrizionale, per l’uomo il glicogeno non ha pressoché importanza in quanto, dopo la morte dell’animale, va incontro a una rapida degradazione, in gran parte a glucosio e poi ad acido lattico. Da notare che l’acidità che si sviluppa migliora gradualmente la consistenza e la conservazione della carne. Le uniche possibili fonti alimentari sono le ostriche e altri frutti di mare che vengono consumati praticamente vivi; ne contengono un 5%.
Indice
- La scoperta
- Struttura chimica e molecolare
- Granuli beta
- Granuli alfa
- Metabolismo del glicogeno: la fase di sintesi
- Metabolismo del glicogeno: la fase degradativa
- Regolazione coordinata del metabolismo del glicogeno
- Dove si trova il glicogeno nell’uomo?
- Perché per l’uomo è importante?
- Glicogeno e lavoro muscolare
- Resa energetica in condizioni anaerobiche
- Resa energetica in condizioni aerobiche
- Bibliografia
La scoperta
Il glicogeno venne scoperto nel 1857 dal fisiologo francese Claude Bernard, considerato il fondatore della medicina sperimentale. Nella seconda metà del ‘900 gli studi sul metabolismo del glicogeno hanno intrecciato grandi progressi della biochimica, come la scoperta:
- della fosforilazione reversibile delle proteine;
- delle protein chinasi e protein fosfatasi;
- del ruolo dei ligandi nel controllo dell’attività degli enzimi allosterici;
- dell’effetto dell’insulina sull’attività degli enzimi intracellulari.
Il tutto ha portato a quattro premi Nobel, di cui tre per la fisiologia o medicina, nell’ordine nel 1947 a Carl Cori e Gerty Theresa Cori, nata Radnitz, nel 1971 a Earl Sutherland Jr., e nel 1992 a Edwin Krebs ed Edmond Fischer, e uno per la chimica, nel 1970 a Louis Leloir.
Struttura chimica e molecolare
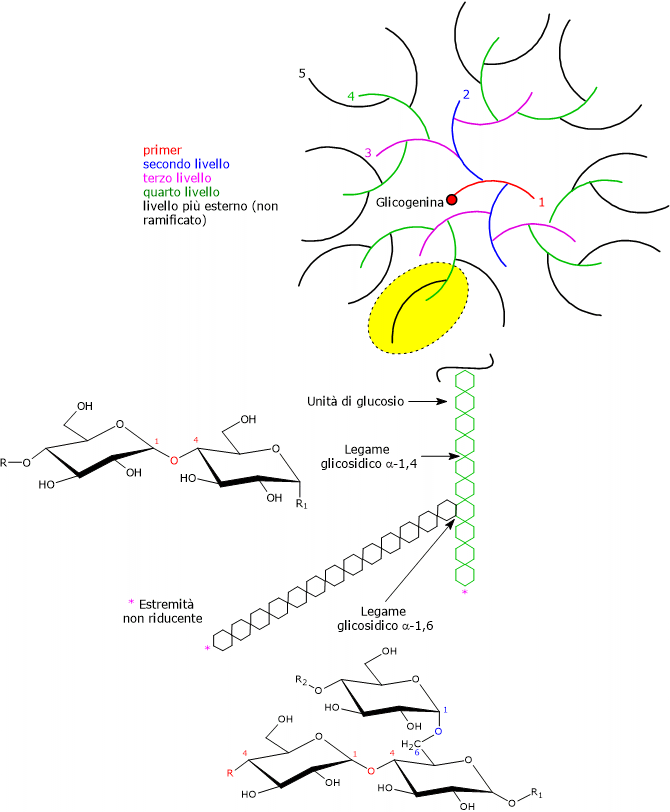
Il glicogeno è un polimero molto grande e ramificato di unità di D-glucosio presenti in forma piranosica, ossia anelli essenzialmente rigidi a sei atomi, cinque di carbonio e uno di ossigeno, con conformazione a sedia.
Alla catena polisaccaridica si legano covalentemente la glicogenina e gruppi fosfato.
La maggior parte delle unità di glucosio sono legate attraverso legami glicosidici α-1,4, in cui ciascuna molecola è legata alla successiva da un legame covalente tra il C-1 di una unità e il gruppo ossidrilico sul C-4 dell’unità successiva, con un atomo di ossigeno che fa da ponte tra due atomi di carbonio.
I punti di ramificazione originano da legami glicosidici α-1,6 presenti all’incirca ogni 8-12 residui, di nuovo con un atomo di ossigeno a fare da ponte tra due atomi di carbonio, in questo caso C-1 e C-6. Nei mammiferi le ramificazioni hanno una lunghezza media di circa 13 residui. Poiché ogni ramificazione termina con un residuo non riducente, nella molecola saranno presenti n +1 estremità non riducenti, dove n è il numero di catene, ma solo una estremità riducente a cui è legata la glicogenina.
Nota: nei disaccaridi, oligosaccaridi e polisaccaridi l’estremità non riducente è l’estremità priva di un atomo di carbonio anomerico libero.
 Contenendo gli stessi legami glicosidici, la struttura primaria del glicogeno ricorda quella dell’amilopectina, che con l’amilosio è uno dei due polimeri di D-glucosio che formano l’amido. Tuttavia nel glicogeno le ramificazioni sono più frequenti rispetto all’amilopectina, dove ricorrono ogni 25-30 residui, e più piccole.
Contenendo gli stessi legami glicosidici, la struttura primaria del glicogeno ricorda quella dell’amilopectina, che con l’amilosio è uno dei due polimeri di D-glucosio che formano l’amido. Tuttavia nel glicogeno le ramificazioni sono più frequenti rispetto all’amilopectina, dove ricorrono ogni 25-30 residui, e più piccole.
A differenza delle proteine e degli acidi nucleici, i polisaccaridi sono sintetizzati senza ricorrere a uno stampo, derivando dall’addizione di monosaccaridi o polisaccaridi alla struttura nascente. In aggiunta, poiché i punti di ramificazione sono disposti senza una precisa localizzazione anche molecole aventi la stessa massa non necessariamente avranno la stessa struttura. Ne consegue che, all’interno di un tipo di molecole sono presenti strutture chimiche diverse.
Considerando poi molecole di glicogeno isolate da differenti organismi, queste si presentano anche come una popolazione di differenti dimensioni. Risulta quindi che il meglio che si possa fare per descriverne la struttura sia quello di definirne la distribuzione delle masse molecolari e la frequenza e lunghezza media delle ramificazioni.
Infine va sottolineato che il glicogeno non è un’entità statica ma le sue dimensioni variano nel corso della sua esistenza.
Nota: essendo una molecola con centri di chiralità, il glucosio è presente come due enantiomeri, indicati secondo la convenzione di Fischer come D-glucosio, il più diffuso in Natura e monosaccaride costituente il glicogeno e l’amido, e L-glucosio.
Chi stabilizza la struttura 3D?
Il ripiegamento in strutture tridimensionali di macromolecole quali proteine, acidi nucleici e polisaccaridi è governato dagli stessi principi: le unità costituenti, ossia amminoacidi, nucleotidi e monosaccaridi, dotate di struttura più o meno rigida, sono unite da legami covalenti a formare catene molecolari unidimensionali che spontaneamente si ripiegano a dare strutture tridimensionali stabilizzate da interazioni non covalenti quali:
- legami idrogeno;
- interazioni di van der Waals;
- interazioni idrofobiche;
- legami ionici, quando presenti unità dotate di carica.
Queste interazioni possono stabilirsi all’interno di macromolecole o tra macromolecole, come nel caso delle strutture sopramolecolari come le fibre di cellulosa o i complessi multienzimatici.
Dato che l’anello piranosico del glucosio è una struttura essenzialmente rigida, la conformazione tridimensionale degli oligosaccaridi e polisaccaridi da esso costituiti deriva dalla rotazione attorno ai due legami C-O del legame glicosidico, rotazione che descrive due angoli indicati come Phi e Psi. In linea teorica tale rotazione è libera, dunque gli angoli potrebbero assumere qualsiasi valore compreso tra -180° e +180°. Tuttavia questo non accade a causa dell’ingombro sterico dei sostituenti. Ne consegue che alcune conformazioni saranno molto più stabili di altre, determinando quindi la struttura tridimensionale del polimero. Sia per il glicogeno che per l’amilosio la struttura tridimensionale più stabile è quella di un’elica cava fortemente avvolta e stabilizzata da legami idrogeno intercatena.
Vantaggi della struttura ramificata
La struttura altamente ramificata del glicogeno comporta diversi vantaggi.
- Le estremità non riducenti presenti sul livello più esterno possono fungere da substrato per la glicogeno fosforilasi. Quindi molte glicogeno fosforilasi possono agire simultaneamente permettendo una rapida mobilizzazione, in forma di glucoso-1-fosfato, del glucosio immagazzinato.
- La struttura altamente ramificata permette al glucosio immagazzinatovi di esercitare una pressione osmotica decisamente inferiore rispetto a quella che eserciterebbe se fosse presente in forma monomerica. Se ad esempio si considera l’epatocita, vi è immagazzinata in forma di glicogeno una quantità di glucosio che in forma libera avrebbe una concentrazione di circa 0,4 M, contro una concentrazione reale di glicogeno di circa 0,01 mM. Se quindi il glucosio fosse presente in forma libera, l’osmolarità risultante sarebbe così elevata da provocare un influsso d’acqua tale da causare la lisi cellulare. Inoltre, poiché la concentrazione extracellulare del glucosio è di circa 5 mM, l’ingresso del glucosio nella cellula contro un gradiente di concentrazione tanto elevato sarebbe un processo altamente dispendioso.
- Le ramificazioni consentono la formazione di granuli compatti.
- Se le ramificazioni fossero assenti o comunque poche, per avere un numero di estremità non riducenti paragonabile a quelle presenti nel glicogeno e accumulare una quantità di glucosio paragonabile dovrebbero essere prodotti polimeri lineari molto lunghi. Questo potrebbe provocare danni alla cellula. Prove a favore di questa ipotesi arrivano da una rara malattia genetica, la malattia di Anderson o amilopectinosi o glicogenosi tipo 4, dovuta a mutazioni a carico del gene che codifica per l’enzima ramificante. Queste mutazioni causano una deficienza dell’attività dell’enzima e l’accumulo in diversi tessuti di glicogeno anormalmente ramificato, che ricorda l’amilopectina.
- Le ramificazioni permettono al glicogeno di rimanere solubile, a differenza dell’amido.
Il modello di Whelan
Per effetto dell’attività della glicogenina, e di seguito della glicogeno sintasi e dell’enzima ramificante, anche detto amilo-alfa-(1,4)→alfa-(1,6)-transglicosidasi (EC 2.4.1.18), la molecola del glicogeno cresce in modo esponenziale in livelli concentrici attorno alla glicogenina. Secondo il modello di Whelan della struttura del glicogeno, nella molecola si possono individuare due tipi di catene di glucosio:
- le catene A, non ramificate e presenti solo sulla superficie;
- le catene B, interne, con in media due ramificazioni.
È stato calcolato che la dimensione massima è pari 12 livelli, per un diametro di circa 42 nm, un numero totale di unità di glucosio di circa 55.000, e una massa molecolare di circa 55 kDa.
Inoltre, considerando che ogni livello ha uno spessore di 3,8 nm, assumendo che la molecola di glicogeno sia una sfera, dal terzo al dodicesimo livello:
- il diametro aumenta di 5,4 volte;
- il volume, che aumenta secondo il cubo del raggio, aumenta di 156 volte;
- il contenuto in carboidrati cresce 45,6 volte;
- il numero di catene A in ciascun livello più esterno aumenta in modo esponenziale, ed è pari a 2n −1, dove n corrisponde al numero del livello.
| Livello | Diametro (nm) | Catene/Livello | Glucosio/Livello | Glucosio totale |
|---|---|---|---|---|
| 1 | — | 1 | 13 | 13 |
| 2 | 3.8 | 3 | 26 | 39 |
| 3 | 7.8 | 7 | 52 | 91 |
| 4 | 11.6 | 15 | 104 | 195 |
| 5 | 15.4 | 31 | 208 | 403 |
| 6 | 19.2 | 63 | 416 | 819 |
| 7 | 23.0 | 127 | 832 | 1651 |
| 8 | 26.8 | 255 | 1664 | 3315 |
| 9 | 30.6 | 511 | 3328 | 6643 |
| 10 | 34.4 | 1023 | 6656 | 13299 |
| 11 | 38.2 | 2047 | 13312 | 26611 |
| 12 | 42.0 | 4095 | 26624 | 53235 |
Considerando il muscolo scheletrico, l’analisi delle dimensioni delle molecole di glicogeno ha evidenziato la presenza di poche particelle di dimensioni massime e un diametro medio di circa 25 nm, corrispondente a sette livelli.
Una caratteristica importante del modello di Whelan è che il livello più esterno conterrebbe, sotto forma di catene A, circa il 50% di tutte le molecole di glucosio presenti. Ciò non significa che queste molecole siano tutte accessibili alla glicogeno fosforilasi perché l’enzima si blocca a quattro residui di distanza dal punto di ramificazione. A questo punto l’enzima deramificante, la cui che attività è più lenta rispetto a quella della glicogeno fosforilasi, rimuove la ramificazione rimasta permettendo alla glicogenolisi di procedere.
Perché non è possibile raggiungere il tredicesimo livello? Il tredicesimo livello sembra non essere possibile a causa dell’ingombro sterico dovuto all’elevata densità di unità di glucosio che si verrebbe a trovare sulla superficie della molecola. La densità sarebbe cioè tale da far si che non sia disponibile uno spazio insufficiente per l’interazione tra la regione catalitica degli enzimi del metabolismo del glicogeno, e quindi anche della glicogeno sintasi, e le catene nascenti.
Inoltre, attraverso analisi matematiche, è stato suggerito che i valori della lunghezza delle ramificazioni, quindi circa 13 residui glucidici nei mammiferi, della frequenze medie delle ramificazione per livello, 2, e del numero massimo di livelli, 12, siano quelli ottimali per ottenere la mobilizzazione della quantità massima di molecole di glucosio nel più breve tempo possibile.
Glicogenina
La struttura della molecola del glicogeno include una proteina disposta al centro, la glicogenina, che è covalentemente legata alla catena polisaccaridica. La proteina da inizio alla sintesi del glicogeno via autoglicosilazione, catalizzando l’addizione di 7-11 unità di glucosio a uno specifico residuo di tirosina. L’oligosaccaride neoformato funge quindi da substrato per la glicogeno sintasi. In aggiunta, la glicogenina, legandosi ai filamenti di actina, ancora il polisaccaride nascente al citoscheletro.
Gruppi fosfato
Oltre alla glicogenina, la molecola del glicogeno lega covalentemente anche gruppi fosfato.
Per molti anni la loro presenza fu considerata una contaminazione, tanto che la quantità presente era correlata al grado di purezza del preparato. Solamente nei primi anni 80 del secolo scorso venne riconosciuto che i gruppi fosfato erano parte integrante del polisaccaride, dove sembra siano legati ai C-2 e C-3 in forma di monoestere, forse introdotto come reazione collaterale nel corso dell’attività della glicogeno sintasi.
Molti lavori indicano che la loro presenza ma faccia parte di un sistema di regolazione del metabolismo del glicogeno, in analogia con quanto accade per il metabolismo dell’amido nelle piante. Prove a sostegno di questa ipotesi sono rappresentata dall’identificazione della glicogeno fosfatasi laforina e dal fatto che una sua mutazione è un fattore chiave nella malattia di Lafora, una forma di epilessia caratterizzata, tra l’altro, da un’eccessiva fosforilazione del glicogeno.
Ma come agirebbero? Sono state fatte diverse ipotesi, e di seguito se ne riportano due.
- Sembra che i gruppi fosfato, che sono idrofilici, possano esporre regioni idrofobiche della molecola riducendone la solubilità. Le defosforilazioni operate dalla laforina, permettendo alla molecola di rimanere solubile, faciliterebbero il processo di ramificazione.
- Secondo un’altra ipotesi il grado di fosforilazione sarebbe correlato all’età della molecola e rappresenterebbe una sorta di controllo di qualità. L’aumento delle fosforilazioni, che comporta una riduzione della solubilità della molecola, agirebbe da marker metabolico che la indirizza, anziché verso la glicogenolisi, verso la degradazione lisosomiale mediante un processo detto glicofagia.
Granuli beta
Le singole molecole di glicogeno sono troppo piccole per essere osservate attraverso microscopia ottica. La microscopia elettronica ha invece permesso di identificare tre tipi di strutture: i granuli beta, le particelle gamma, e i granuli alfa.
I granuli beta sono costituiti dal polisaccaride, dalla glicogenina e dalle particelle gamma, particelle ricche di proteine con un diametro di circa 3 nm. I granuli beta hanno un peso molecolare di circa 106-107 kDa, un diametro di circa 20-30 nm, con una forma simile a rosette. Sono considerate una fonte di energia rapidamente disponibile.
In condizioni fisiologiche le proteine costituiscono il 66-80% del peso del granulo, proteine che stabiliscono legami anche tra di loro, con le membrane e con il citoscheletro, e sono coinvolte nel metabolismo del polisaccaride. Alcune di queste sono:
- la glicogeno sintasi, l’enzima deramificante e la glicogeno fosforilasi;
- varie proteine regolatorie quali:
- le fosfatasi laforina e fosfoprotein fosfatasi 1 o PP1 (EC 3.1.3.17);
- le chinasi fosforilasi chinasi (EC 2.7.11.19) e AMPK (EC 2.7.11.31);
- la proteina di ancoraggio alle membrane STDB1 (anche la fosforilasi chinasi lega le membrane);
- la malina o E3-ubiquitina ligasi (EC 2.3.2.27), che si lega al glicogeno attraverso una interazione con la laforina, e TRIM7.
A differenza di quanto accade con il complesso della piruvato deidrogenasi o con i ribosomi, la stechiometrica dei granuli beta non è costante, bensì assai dinamica, in quanto le proteine si associano o dissociano dal granulo a seconda delle condizioni cellulari. In aggiunta, differenze si osservano oltre che tra tipi cellulari differenti anche all’interno di uno stesso tipo cellulare, ad esempio nelle cellule del muscolo scheletrico in base alle differenti localizzazioni subcellulari.
Granuli alfa
Nel fegato i granuli beta sono organizzati a formare un’ulteriore entità strutturale, i granuli alfa.
Si tratta di strutture formate da diversi granuli beta, con un diametro fino a 300 nm e un peso molecolare di oltre 108 kDa, e che, alla microscopia elettronica, appaiono con una forma simile ai broccoli.
I granuli alfa sono ritenuti una fonte di energia più lenta rispetto ai granuli beta.
Attualmente non è ancora chiaro il meccanismo alla base della loro formazione, anche se sembra che i granuli beta siano legati attraverso uno scheletro proteico ricco in ponti disolfuro.
Metabolismo del glicogeno: la fase di sintesi
Il glicogeno viene accumulato nella cellula quando l’apporto di nutrienti è adeguato.
La sintesi del glicogeno avviene nel citosol, sembra essere associata ai filamenti di actina, e può avvenire a partire dal glucosio derivante dai carboidrati assunti con l’alimentazione, o dal glucosio derivante da precursori non glucidici, quali acido lattico e alanina.
Il lattato che si accumula nelle cellule muscolari scheletriche in condizioni di scarsa disponibilità di ossigeno, nei globuli rossi, che dipendono interamente dalla glicolisi anaerobica per la produzione di ATP, o derivante da altri tessuti, viene metabolizzato per la maggior parte a livello epatico per la produzione di glucosio attraverso la gluconeogenesi. Il glucosio prodotto diffonde dagli epatociti nel circolo ematico ed è trasportato ai tessuti periferici, tra cui anche il muscolo scheletrico dove può essere convertito a lattato, chiudendo così un ciclo che è conosciuto come ciclo di Cori.
L’alanina, un amminoacido non essenziale, può derivare da processi transaminativi in cui il piruvato di origine glicolitica funge da accettore del gruppo amminico di aminoacidi utilizzati a scopi energetici. L’alanina rappresenta quindi il mezzo di trasporto dello scheletro carbonioso della base coniugata dell’acido piruvico, il piruvato, e dei gruppi amminici dai tessuti extraepatici al fegato dove, lo scheletro carbonioso verrà utilizzato per produrre glucosio attraverso la via gluconeogenetica, e il gruppo amminico convertito in urea attraverso il ciclo dell’urea. Il glucosio diffonde quindi nel circolo sanguigno e raggiunge i tessuti extraepatici dove può essere riconvertito in piruvato chiudendo il ciclo, che è conosciuto come ciclo glucosio-alanina.
Il glucosio entra nelle cellule utilizzando specifici trasportatori chiamati GLUT, dall’inglese glucose transporter, dei quali GLUT4 prevale in tessuti insulino-dipendenti o insulino-sensibili, quali il muscolo scheletrico e cardiaco e il tessuto adiposo, ed è esso stesso attivato dall’ormone.
Una volta nella cellula il glucosio viene fosforilato a glucosio-6-fosfato. La reazione è catalizzata dalla glucochinasi o esochinasi IV (EC 2.7.1.1) nel fegato e nelle cellule beta del pancreas, e dalle altre esochinasi negli altri tipi cellulari.
Il destino del glucosio-6-fosfato dipenderà dallo stato metabolico della cellula. Può entrare nella via glicolitica per produrre energia e/o precursori per altre vie metaboliche. In alternativa può subire una isomerizzazione a glucosio-1-fosfato, un esempio di isomeria di posizione, nella reazione reversibile catalizzata dalla fosfoglucomutasi (EC 5.4.2.2). Il glucosio-1-fosfato può essere incanalato nella via di sintesi del glicogeno, o nella via del pentoso fosfato se la cellula necessita di NADPH per le biosintesi riduttive, come quelle degli acidi grassi o del colesterolo, o di ribosio-5-fosfato per la sintesi dei nucleotidi.
Quando prevale la sintesi del glicogeno, il glucosio-1-fosfato viene attivato a UDP-glucosio nella reazione catalizzata dalla UDP-glucosio pirofosforilasi (EC 2.7.7.9), a spese di una molecola di UTP. L’UDP-glucosio è il donatore di glucosio. Inizialmente la glicogenina catalizza la glicosilazione di un suo residuo di tirosina, dopo di che aggiunge altri 6-10 unità di glucosio a formare un oligosaccaride di 7-11 unità. La catena oligosaccaridica funge quindi da substrato per la glicogeno sintasi che, in combinazione con l’enzima ramificante, completa la sintesi del glicogeno.
Metabolismo del glicogeno: la fase degradativa
A differenza della sintesi del glicogeno, la fase catabolica o degradativa avviene sia nel citosol che nei lisosomi, ma con l’intervento di differenti vie metaboliche.
La glicogenolisi è associata al reticolo endoplasmatico e al reticolo sarcoplasmatico, avendo come fine la liberazione a scopi energetici del glucosio. Le reazioni catalizzate dalla glicogeno fosforilasi, dalla alfa-(1,4)-glucan-6-glicosiltransferasi e dall’amilo-alfa-(1,6)-glucosidasi o enzima deramificante portano alla liberazione del glucosio in forma di glucosio-1-fosfato, per il 90% circa, e di glucosio libero per il restante 10%. A livello della cellula muscolare scheletrica l’attività della esochinasi è così intensa che tutto il glucosio libero è immediatamente fosforilato a glucosio-6-fosfato, e dunque bloccato nella cellula stessa. Negli epatociti, nelle cellule della corteccia renale e negli enterociti, essendo presente la via gluconeogenetica, l’enzima glucosio-6-fosfatasi (EC 3.1.3.9) catalizza la defosforilazione del glucosio-6-fosfato, derivante dalla isomerizzazione del glucosio-1-fosfato, a glucosio che può lasciare la cellula e contribuire alla regolazione della glicemia.
Degradazione nei lisosomi
Sebbene il glicogeno sia sintetizzato nel citosol, si ritrovato anche nei lisosomi. Il glicogeno lisosomiale sembra derivare da meccanismi di autofagia, e interessa circa il 10% del contenuto totale del glicogeno epatico e circa il 5% di quello muscolare.
Secondo una ipotesi, il grado di fosforilazione del granulo di glicogeno sarebbe uno dei fattori chiave nella regolazione del suo metabolismo lisosomiale. Il grado di fosforilazione correlerebbe con l’età del granulo, rappresentando una sorta di controllo di qualità: l’aumento delle fosforilazioni, con la conseguente riduzione della solubilità del granulo, costituirebbe un marker in grado di indirizzare il metabolismo del glicogeno verso la fase di degradazione lisosomiale, un processo noto anche come glicofagia.
Nei lisosomi la degradazione del polisaccaride avviene nella reazione catalizzata dall’enzima alfa-(1,4)-glucosidasi acida (EC 3.2.1.20). L’idrolisi porta alla liberazione di D-glucosio. Poiché l’enzima idrolizza di preferenza i legami glicosidici α-(1,4), non è ancora chiaro come vengano idrolizzati i legami glicosidici α-(1,6).
L’importanza del catabolismo lisosomiale del glicogeno è sottolineata dalla malattia di Pompe o glicogenosi di tipo II, causata da una mutazione del gene per la alfa-glucosidasi acida. La carenza di alfa-glucosidasi acida funzionante causa un accumulo di glicogeno nei lisosomi e in strutture vescicolari. Nella sua forma più grave la malattia di Pompe risulta fatale entro il primo anno di vita.
Regolazione coordinata del metabolismo del glicogeno
La sintesi e la degradazione del glicogeno sono processi esoergonici, per cui se operassero simultaneamente si avrebbe uno spreco di energia. Nella cellula le due vie metaboliche sono soggette a uno stretto controllo e sono reciprocamente regolate in modo che quando una via procede l’altra rallenta. Al pari di quanto accade per la regolazione coordinata della glicolisi e della gluconeogenesi, ciò è stato ottenuto nel corso dell’evoluzione attraverso la selezione di enzimi differenti per catalizzare i passaggi chiave delle due vie. Gli enzimi chiave in questione sono la glicogeno fosforilasi e la glicogeno sintasi, la cui attività viene regolata per mezzo di:
- meccanismi allosterici, che avvengono in un arco temporale di millisecondi, sono istantaneamente reversibili, e chiamano in causa quali effettori allosterici gli ioni calcio (Ca2+), il glucosio, e metaboliti che segnalano lo stato energetico della cellula, ossia l’ATP, l’AMP e il glucosio-6-fosfato;
- modificazioni covalenti, ossia fosforilazioni e defosforilazioni di specifiche proteine bersaglio quali, oltre ai due enzimi suddetti, la fosforilasi chinasi, fosfoprotein fosfatasi 1, e la glicogeno sintasi chinasi 3 (EC 2.7.11.26).
La regolazione covalente avviene in un arco temporale di secondi, ed è conseguente al legame di ormoni, di cui i più importanti sono l’ insulina, il glucagone e l’adrenalina o epinefrina, ai rispettivi recettori presenti sulla membrana plasmatica.
Nella regolazione coordinata del metabolismo del glicogeno i meccanismi allosterici e covalenti si sovrappongono.
Regolazione covalente
Di seguito sono riassunte le modificazioni metaboliche indotte dal legame di insulina, glucagone e adrenalina ai rispettivi recettori epatici e muscolari.
L’insulina viene rilasciata dalle cellule beta delle isole pancreatiche di Langerhans in risposta all’aumento della glicemia conseguente, ad esempio, a un pasto ricco di carboidrati, e ha un’azione anabolica. Il legame ai recettori presenti sulla membrana plasmatica delle cellule del fegato e del muscolo scheletrico innesca una cascata di reazioni che determinano la defosforilazione della:
- glicogeno fosforilasi, che risulta inibita;
- glicogeno sintasi, che risulta attivata.
In aggiunta, l’insulina recluta sulla membrana plasmatica delle cellule del muscolo scheletrico il trasportatore GLUT4. In questo modo viene stimolata la sintesi del glicogeno e inibita la glicogenolisi. Ciò concorre ad abbassare la glicemia.
Il glucagone viene secreto dalle cellule alfa delle isole pancreatiche di Langerhans in risposta a una riduzione della glicemia, e ha un’azione catabolica. Il legame dell’ormone ai recettori presenti sulla membrana plasmatica degli epatociti innesca una cascata di reazioni che portano alla fosforilazione della:
- glicogeno fosforilasi, che risulta attivata;
- glicogeno sintasi, che risulta inibita.
In questo modo viene attivata la glicogenolisi e inibita la sintesi del glicogeno. Ciò concorre ad aumentare la glicemia.
L’adrenalina viene secreta dalle ghiandole surrenali in risposta a segnali provenienti dal sistema nervoso simpatico innescati da situazioni che provocano paura o stress, ma anche a seguito di un esercizio fisico particolarmente intenso. Al pari del glucagone ha un’azione catabolica in quanto determina la fosforilazione della:
- glicogeno fosforilasi, attivandola;
- glicogeno sintasi, inibendola.
Tuttavia, a differenza del glucagone agisce sia sul fegato che sul muscolo scheletrico, a seguito del legame ai recettori adrenergici, beta-2 nel muscolo scheletrico, e beta-2 e alfa-1 nel fegato.
La vasopressina e l’adrenalina, quando si lega ai recettori alfa-1 adrenergici, innescano vie intracellulari che portano al rilascio di ioni calcio dal reticolo endoplasmatico, e, come spiegato in seguito, alla stimolazione della glicogenolisi e inibizione della sintesi del glicogeno.
Regolazione allosterica
Di seguito sono riassunte le modificazioni metaboliche indotte dal legame degli effettori allosterici AMP, ATP, glucosio-6-fosfato, glucosio e ioni calcio ai rispettivi siti di legame presenti sugli enzimi bersaglio.
MUSCOLO SCHELETRICO
A seguito di un aumento della concentrazione dell’AMP:
- la fosforilasi chinasi è attivata;
- la glicogeno fosforilasi b è attivata.
A seguito di un aumento della concentrazione dell’ATP:
- la fosforilasi chinasi è inibita;
- la glicogeno fosforilasi b è inibita.
In risposta a un aumento della concentrazione del glucosio-6-fosfato:
- PP1 è attivata;
- la glicogeno fosforilasi b è inibita;
- la forma fosforilata della glicogeno sintasi, ossia la glicogeno sintasi a, è attivata, a seguito di un cambio conformazionale che favorisce la defosforilazione per opera di PP1. Questa attivazione allosterica permette alla glicogeno sintasi di agire da sensore per il glucosio-6-fosfato.
Quindi, se le concentrazioni dell’ATP e del glucosio-6-fosfato sono basse ed è alta quella dell’AMP, la glicogeno sintasi è inibita, glicogeno fosforilasi è stimolata, e di conseguenza la glicogenolisi è stimolata mentre la sintesi del glicogeno è inibita.
Di contro, se la concentrazione dell’ATP e del glucosio-6-fosfato sono elevate, viene stimolata la sintesi del glicogeno e inibita la glicogenolisi.
Nelle cellule muscolari scheletriche l’aumento della concentrazione intracellulare di ioni calcio, rilasciato dal reticolo sarcoplasmatico, innesca la contrazione muscolare. Inoltre, ioni calcio si lega alla calmodulina, che è la subunità delta della fosforilasi chinasi muscolare. Il complesso ioni calcio-calmodulina attiva la chinasi che fosforila la glicogeno fosforilasi e la glicogeno sintasi, attivando la prima e inibendo la seconda.
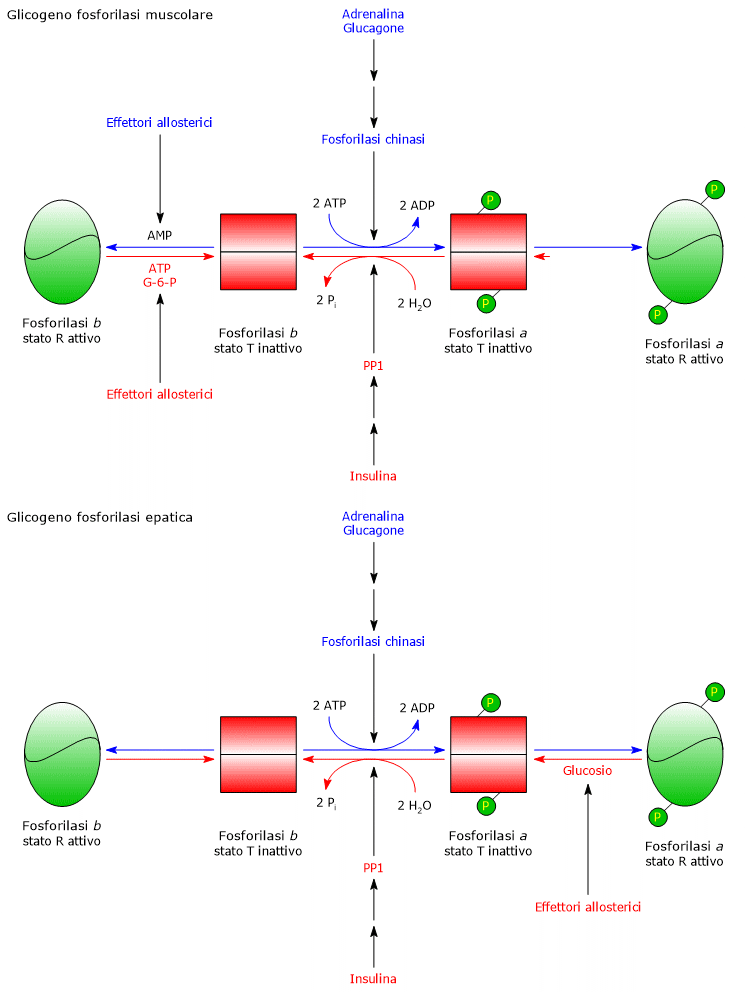
FEGATO
Nel fegato la glicogeno fosforilasi b non è attivata dall’AMP, mentre la glicogeno fosforilasi a è inattivata a seguito di un aumento della glicemia. In che modo? La concentrazione del glucosio nel fegato riflette quella nel sangue: in risposta a un aumento della glicemia il glucosio si lega a uno specifico sito allosterico inibitore della glicogeno fosforilasi a e innesca una modificazione conformazionale che porta all’esposizione di specifici residui di serina fosforilati che vengono defosforilati da PP1, con conseguente inattivazione dell’enzima. Ciò permette alla glicogeno fosforilasi di agire come sensore del glucosio e di rispondere in modo adeguato alle sue variazioni ematiche.
Dove si trova il glicogeno nell’uomo?
Nell’uomo il glicogeno è presente in tutte le cellule. Tuttavia i principali depositi si trovano nel fegato e nel muscolo scheletrico, dove, a seconda dello stato nutrizionale, il polisaccaride può rappresentare fino al 10% della massa del fegato e al 2% di quella del muscolo. Quindi il muscolo, rispetto al fegato, ha una limitata capacità di immagazzinare glicogeno; tuttavia, poiché la sua massa è maggiore rispetto a quella del fegato la quantità presente è circa il doppio di quella che si ritrova nel fegato. Ad esempio, in un soggetto adulto maschio di 70 kg non a digiuno ci sono circa 250 g di glicogeno muscolare e circa 100 g di glicogeno epatico. Questi valori possono leggermente aumentare negli atleti, come nei migliori maratoneti maschi dove le riserve, tra muscolo e fegato, arrivano fino a circa 475 g, pari a circa 1900 kcal.
Le quantità di glicogeno immagazzinate sono decisamente inferiori rispetto a quelle dei grassi perché questi ultimi sono una forma di deposito di energia molto più efficiente in quanto:
- possono essere immagazzinati in forma anidra, mentre il glicogeno lega una quantità d’acqua pari a circa il doppio del suo peso;
- essendo i grassi accumulati insolubili in acqua sono osmoticamente inerti;
- dall’ossidazione di un grammo di grasso si ottiene circa il doppio delle kilocalorie derivanti dall’ossidazione di un grammo di glicogeno: 9 vs 4.
Perché per l’uomo è importante?
I grassi, le proteine e il glicogeno sono i depositi di energia cui il corpo attinge in caso di bisogno.
Negli animali i grassi sono secondi solo alle proteine come riserva di energia, sebbene le proteine siano un scorta cui l’organismo attinge come ultima istanza, ad esempio nel digiuno prolungato. Considerando un soggetto adulto normopeso i grassi rappresentano circa il 21% del peso nell’uomo e il 26% nella donna. Per un uomo sano di circa 70 kg la massa grassa è sufficiente a soddisfare le richieste energetiche dell’organismo per circa 2 mesi. Invece il glicogeno può soddisfare tali richieste solo per circa un giorno. Tuttavia il glicogeno viene immagazzinato. Perché?
- A differenza del glucosio, gli acidi grassi, una classe di lipidi, non possono essere metabolizzati anaerobicamente, per cui non possono essere utilizzati dal muscolo scheletrico impegnato in lavori in carenza di ossigeno. Va tuttavia sottolineato che la resa energetica del glicogeno, o meglio del glucosio rilasciato dal glicogeno è differente in condizioni anerobiche e aerobiche. Infine, il muscolo non riesce a mobilizzare gli acidi grassi così velocemente come fa con il glucosio immagazzinato nel glicogeno.
- Gli animali non sono in grado di convertire gli acidi grassi in glucosio, e quindi non possono essere utilizzati per mantenere l’omeostasi glicemica. Sebbene nel muscolo il glucosio rilasciato dal glicogeno rimanga all’interno della cellula, nel fegato, e in misura minore nel rene, il glucosio rilasciato, grazie alla presenza dell’enzima glucosio-6-fosfatasi, entra nella circolazione sistemica concorrendo alla regolazione della glicemia.
- Durante la vita fetale il glicogeno svolge un ruolo importante nelle cellule polmonari di tipo II o pneumociti di tipo II, le cellule polmonari attaccate dal SARS-CoV-2. Intorno alla 26° settimana di gestazione queste cellule iniziano ad accumulare glicogeno, e in seguito a sintetizzare il surfattante polmonare utilizzandolo come principale substrato per la sintesi dei lipidi del surfattante stesso, di cui la dipalmitoilfosfatidilcolina è il componente più importante.
- Il cervello contiene una piccola quantità di glicogeno, localizzata principalmente negli astrociti. Si accumula durante il sonno ed è mobilizzato al risveglio, il che suggerisce un suo ruolo funzionale nel cervello cosciente. Questa riserva di glucosio fornisce anche un moderato grado di protezione nei confronti dell’ipoglicemia.
Glicogeno e lavoro muscolare
I carboidrati, ossia il glucosio, e gli acidi grassi rappresentano le principali fonti di energia per il muscolo durante l’attività fisica, e il loro contributo relativo varia in funzione dell’intensità e durata dell’esercizio, come descritto di seguito:
- <30% VO2max: principalmente acidi grassi;
- 40-60% VO2max: acidi grassi e carboidrati in egual misura;
- 75% VO2max: principalmente carboidrati;
- >80% VO2max: circa 100% carboidrati;
Quindi il contributo del glicogeno al totale dell’energia necessaria per sostenere il lavoro muscolare aumenta con l’aumentare dell’intensità dell’esercizio, mentre si riduce quello degli acidi grassi.
Inoltre, se non sono assunti carboidrati, la prestazione è determinata dalle riserve endogene di glicogeno muscolare ed epatico, il cui consumo relativo è differente: all’aumentare dell’intensità aumenta il consumo del glicogeno muscolare mentre il consumo del glicogeno epatico rimane più o meno costante.
Nota: il contributo relativo di acidi grassi e glicogeno come fonti di energia varia anche in funzione del livello di allenamento dell’atleta.
Resa energetica in condizioni anaerobiche
In condizioni anaerobiche, l’ossidazione di una molecola di glucosio a lattato attraverso la glicolisi anaerobica porta alla produzione di due molecole di ATP.
Di seguito viene analizzata la resa in ATP dall’ossidazione anaerobica del glucosio rilasciato dal glicogeno nel corso della glicogenolisi.
Glicogeno fosforilasi e ossidazione del glucosio-1-fosfato in condizioni anaerobiche
La sintesi del glicogeno dal glucosio comporta il consumo di due molecole di ATP per ogni molecola immagazzinata.
Il rilascio di una molecola di glucosio-1-fosfato per azione della glicogeno fosforilasi permette il risparmio di una delle due molecole di ATP utilizzate nella fase preparatoria della glicolisi. L’ossidazione anaerobica del glucosio-6-fosfato, prodotto dal glucosio-1-fosfato nella reazione catalizzata dalla fosfoglucomutasi, porta alla produzione di tre molecole di ATP e non due, in quanto:
- nella fase preparatoria della glicolisi è consumata una molecola di ATP e non due, essendo bypassata la reazione catalizzata dalla esochinasi;
- quattro molecole di ATP sono prodotte nella fase di recupero energetico della glicolisi.
Il rapporto spesa-guadagno è 1/3, quindi si ha una resa energetica di circa il 66,7%.
La reazione complessiva è:
Glicogeno(n residui di glucosio) + 3 ADP + 3 Pi → Glicogeno(n-1 residui di glucosio) + 2 Lattato + 3 ATP
Considerando le due molecole di ATP spese nel corso della sintesi del glicogeno e l’ossidazione anaerobica del glucosio-1-fosfato a lattato, si ha una resa pari a una molecola di ATP per molecola di glucosio immagazzinata.
La reazione complessiva è:
Glucosio + ADP + Pi → 2 Lattato + ATP
Enzima deramificante e ossidazione del glucosio in condizioni anaerobiche
Considerando il glucosio liberato per azione dell’enzima deramificante, la resa in ATP è pari a zero in quanto:
- la sintesi del glicogeno dal glucosio comporta la spesa di due molecole di ATP;
- l’enzima deramificante libera glucosio, dunque nella fase preparatoria della glicolisi saranno spese due molecole di ATP;
- quattro molecole di ATP sono prodotte nella fase di recupero energetico della glicolisi.
Se ora si considera l’ossidazione sino a lattato di tutto il glucosio provenienti dal glicogeno si ha una resa energetica pari a:
1-{[(1/3)*0,9]+[(2/2)*0,1]}=0,60
Ne consegue che in condizioni anaerobiche, si ha una resa energetica pari al 60%, e quindi il glicogeno rappresenta una buona forma di riserva di energia.
Resa energetica in condizioni aerobiche
In condizioni aerobiche, l’ossidazione di una molecola di glucosio a CO2 e H2O attraverso glicolisi, complesso della piruvato deidrogenasi, ciclo di Krebs, catena di trasporto degli elettroni mitocondriale e fosforilazione ossidativa porta alla produzione di circa 30 molecole di ATP.
Di seguito viene analizzata la resa in ATP dall’ossidazione aerobica del glucosio rilasciato dal glicogeno per azione della glicogeno fosforilasi e dell’enzima deramificante.
Glicogeno fosforilasi e ossidazione del glucosio-1-fosfato in condizioni aerobiche
Dall’ossidazione del glucosio-6-fosfato, prodotto dal glucosio-1-fosfato per azione della fosfoglucomutasi, a CO2 e H2O si ottengono 31 molecole di ATP e non 30, grazie all’ATP risparmiato nella fase preparatoria della glicolisi. Dunque, il rapporto spesa-guadagno è di 1/31, con una resa energetica di circa il 97%.
La reazione complessiva è:
Glicogeno(n residui di glucosio) + 31 ADP + 31 Pi → Glicogeno(n-1 residui di glucosio) + 31 ATP + 6 CO2 + 6 H2O
Considerando le due molecole di ATP spese per molecola di glucosio immagazzinata nel glicogeno e l’ossidazione aerobica del glucosio-1-fosfato a CO2 e H2O, si ha una resa pari a 29 molecole di ATP per unità di glucosio immagazzinata.
La reazione complessiva è:
Glucosio + 29 ADP + 29 Pi → 29 ATP + 6 CO2 + 6 H2O
Enzima deramificante e ossidazione del glucosio in condizioni aerobiche
Considerando le unità di glucosio liberate dall’enzima deramificante, la resa in ATP è pari a 30 molecole in quanto la fase preparatoria della glicolisi comporta la spesa di due molecole di ATP. Quindi, il rapporto spesa-guadagno è 2/30, con una resa energetica di circa il 93,3%.
Se ora si considera l’ossidazione a CO2 e H2O di tutte le unità di glucosio provenienti dal glicogeno, si ha una resa energetica pari a:
1-{[(1/31)*0,9]+[(2/30)*0,1]}=0,96
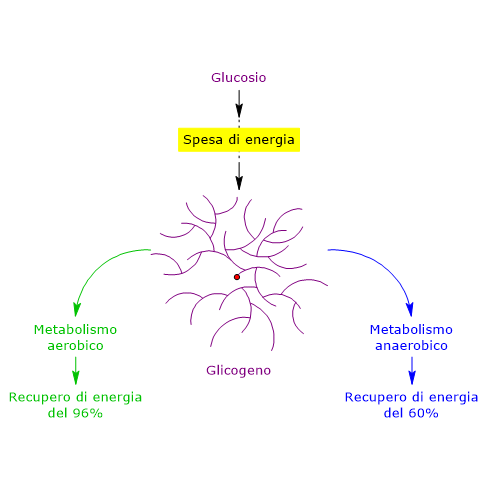
Ne consegue che, in condizioni aerobiche, si ha una resa energetica pari al 96%, e quindi il glicogeno rappresenta una forma di riserva di energia estremamente efficiente, con un guadagno del 36% rispetto alle condizioni anaerobiche.
Bibliografia
- Adeva-Andany M.M., González-Lucán M., Donapetry-García C., Fernández-Fernández C., Ameneiros-Rodríguez E. Glycogen metabolism in humans. BBA Clin 2016;27;5:85-100. doi:10.1016/j.bbacli.2016.02.001
- Alberts B., Johnson A., Lewis J., Morgan D., Raff M., Roberts K., Walter P. Molecular Biology of the Cell. 6th Edition. Garland Science, Taylor & Francis Group, 2015
- Beelen M., Burke L.M., Gibala M.J., van Loon J.C. Nutritional strategies to promote postexercise recovery. Int J Sport Nutr Exerc Metab 2010:20(6);515-32. doi:10.1123/ijsnem.20.6.515
- Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5th Edition. W. H. Freeman and Company, 2002
- Deng B., Sullivan M.A., Chen C., Li J., Powell P.O., Hu Z., Gilbert R.G. Molecular structure of human-liver glycogen. PLoS ONE 2016;11(3):e0150540. doi:10.1371/journal.pone.0150540
- Fontana J.D. The presence of phosphate in glycogen. FEBS Lett 1980;1:109(1):85-92. doi:10.1016/0014-5793(80)81317-2
- Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010
- Gentry M.S., Guinovart J.J., Minassian B.A., Roach P.J., and Serratosa J.M. Lafora disease offers a unique window into neuronal glycogen metabolism. J Biol Chem 2018;293(19):7117-25. doi:10.1074/jbc.R117.803064
- Gunja-Smith Z., Marshall J.J., Mercier C., Smith E.E. and Whelan W.J. A revision of the Meyer-Bernfeld model of glycogen and amylopectin. FEBS Lett 1970:12(2);101-104. doi:10.1016/0014-5793(70)80573-7
- Melendez R., Melendez-Hevia E., and Cascante M. How did glycogen structure evolve to satisfy the requirement for rapid mobilization of glucose? A problem of physical constraints in structure building. J Mol Evol 1997;45(4):446-55. doi:10.1007/PL00006249
- Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012
- Nelson D.L., M. M. Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- Prats C., Graham T.E., and Shearer J. The dynamic life of the glycogen granule. J Biol Chem 2018;293(19):7089-98. doi:10.1074/jbc.R117.802843
- Roach P.J., Depaoli-Roach A.A., Hurley T.D and Tagliabracci V.C. Glycogen and its metabolism: some new developments and old themes. Biochem J 2012;441:763-87. doi:10.1042/BJ20111416
- Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., 2009
- Shearer J. and Graham T.E. Novel aspects of skeletal muscle glycogen and its regulation during rest and exercise. Exerc Sport Sci Rev 2004;32(3):120-6. doi:10.1097/00003677-200407000-00008
- Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 3rd Edition. Elsevier health sciences, 2013 [Google eBooks]
- Voet D. and Voet J.D. Biochemistry. 4th Edition. John Wiley J. & Sons, Inc. 2011
- Whelan W.J. Enzymic explorations of the structures of starch and glycogen. Biochem J 1971;122(5):609-622. doi:10.1042/bj1220609