L’amilopectina è un polisaccaride altamente ramificato formato da unità di alfa-D-glucosio. Insieme all’amilosio è uno dei due principali costituenti dei granuli di amido, il mezzo attraverso cui le piante immagazzinano energia, e la più diffusa e abbondante forma di accumulo di carboidrati presente sulla Terra.[12]
I residui glucosidici sono legati da legami glicosidici α-(1→4) a formare catene da cui si dipartono ramificazioni a mezzo di legami glicosidici α-(1→6).[2]
La sua sintesi richiede l’intervento coordinato di almeno quattro distinte classi di enzimi: le amido sintasi, gli enzimi ramificanti l’amido (EC 2.4.1.18), gli enzimi deramificanti l’amido, e l’amido fosforilasi (EC 2.4.1.1).[17]
Nel granulo di amido l’amilopectina è presente in quantità maggiore rispetto all’amilosio, e forma una matrice semicristallina all’interno della quale si ritiene venga depositato l’amilosio.
Il rapporto amilosio/amilopectina influenza fortemente le proprietà chimico-fisiche dell’amido, e di conseguenza sia i suoi usi industriali, come la produzione di additivi alimentari, che i possibili effetti sulla salute.[3]
Indice
- Struttura dell’amilopectina
- Sintesi dell’amilopectina
- Amido sintasi
- Enzimi ramificanti l’amido
- Enzimi deramificanti l’amido
- Amido fosforilasi
- Fosforilazione dell’amilopectina
- Rapporto amilosio/amilopectina
- Bibliografia
Struttura dell’amilopectina
L’amilopectina è un polisaccaride altamente ramificato con un peso molecolare compreso tra i 107 e 108 Dalton, quindi molto più grande dell’amilosio. Contiene 104-105 molecole di glucosio organizzate a formare molte catene relativamente corte, composte in media da 18-25 molecole di glucosio legate da legami glicosidici α-1,4.[17] La lunghezza delle catene glucosidiche varia a seconda della fonte dell’amido nonché delle condizioni ambientali e nutritive prevalenti nel corso della crescita della pianta e della formazione del seme.
Le catene sono legate tra di loro attraverso legami glicosidici α-1,6, a formare numerose ramificazioni che creano una struttura ad albero, con le catene vicine organizzate in strutture simili a grappoli o cluster.[1]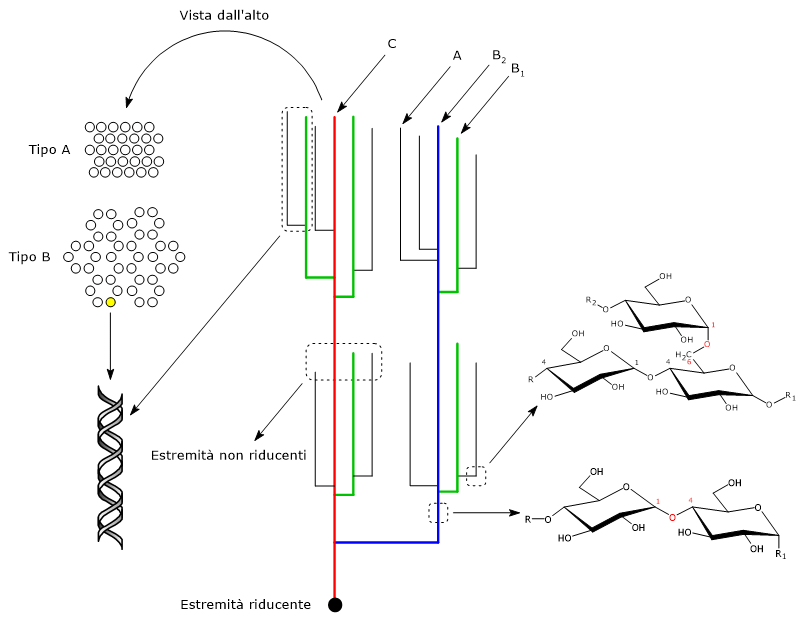
Nella maggior parte degli amidi i legami glicosidici α-1,6 rappresentano circa il 5% di tutti i legami glicosidici, una percentuale più bassa rispetto al 9% che si osserva nella molecola del glicogeno, dove le ramificazioni sono anche più uniformemente distribuite. La lunghezza e la posizione della ramificazioni influenzano direttamente le proprietà fisico-chimiche dell’amilopectina, quali la solubilità, la viscosità, la facilità di retrogradazione e la temperatura di gelificazione e incollaggi.[3] Ad esempio, il glicogeno è solubile in acqua mentre l’amilopectina non lo è.
Catene dell’amilopectina
Le catene glucosidiche dell’amilopectina possono essere classificate sulla base della loro lunghezza o della presenza o assenza di ramificazioni.
La classificazione basata sulla lunghezza individua due tipi principali di catene: le catene corte e lunghe. Le catene corte hanno un grado di polimerizzazione compreso tra 6 e 36, sebbene il limite superiore dipenda dalla fonte di amilopectina, mentre le catene lunghe hanno un grado di polimerizzazione maggiore o uguale a 36. La distribuzione molare delle catene corte e lunghe è dell’ordine di 6-19 nella maggior parte degli amidi, ed è di solito più bassa negli amidi B-cristallini, come quelli delle patate, rispetto agli amidi A-cristallini, come gli amidi di deposito dell’endosperma dei cereali.[17]
La classificazione basata sulle connessioni con altre catene individua tre categorie: catene A, catene B e catene C.[7]
- Le catene A non hanno ramificazioni, sono corte, con un grado di polimerizzazione di circa 13, e sono le catene esterne.
- Le catene B hanno almeno una ramificazione,ossia legano una catena A o B, sono più lunghe delle catene A, e si trovano nella parte più interna della molecola.
Le catene B a loro volta sono state suddivisi in catene B1, che hanno un grado di polimerizzazione di circa 22, le catene B2, con un grado di polimerizzazione di circa 42, le B3, con un grado di polimerizzazione di circa 69, B4 e così via. - La catene C è la catena B che porta l’estremità libera riducente.
Le catene A e le catene B1 partecipano alla formazione dei cluster, mentre si ritiene che le catene B2, B3, e B4 si estendano rispettivamente in due, tre e quattro cluster.[7][11]
Polimorfi di tipo A, B e C
All’interno dei cluster, i segmenti di catena lineari vicini formano doppie eliche, parallele tra di loro, con un periodo di 2,1 nm, e dove ogni giro conta sei unità glucosidiche per catena.[10] Le doppie eliche si dispongono a formare due tipi di strutture cristalline indicate come polimorfo di tipo A, più denso e tipico dell’amido dei cereali, e polimorfo di tipo B, a struttura esagonale, meno denso, più idratato e tipico degli amidi dei tuberi e degli amidi ad alto contenuto di amilosio. In alcuni tipi di amido, come quello presente nelle radici, legumi e alcuni frutti, sono presenti polimorfi miscele dei due precedenti, chiamati polimorfi di tipo C.[2]
Questo tipo di organizzazione è alla base della natura semicristallina dei granuli di amido.
Anelli di crescita
Sebbene i granuli di amido abbiamo forme molto differenti, la loro architettura interna è notevolmente conservata tra le differenti specie. Infatti, quando osservati al microscopio, la maggior parte degli amidi presenta uno schema regolare di strutture ad anello più scure e più chiare, strutture note come anelli di crescita, così chiamati in quanto ricordano gli anelli di crescita delle piante.[10]
Gli anelli di crescita circondano l’ilo del granulo, ossia, il centro del granulo, la cui struttura non è nota, sebbene sembri essere formata da una struttura relativamente disordinata di alfa-glucani. Gli anelli hanno uno spessore di 200-400 nm, e sono formati da regioni amorfe e semicristalline che si alternano, meno dense le prime e più dense le seconde.[10]
Secondo il modello a cluster le regioni semicristalline sono formate dall’alternanza di lamelle cristalline e lamelle amorfe, impilate con una periodicità di circa 9-10 nm.[11] Le lamelle cristalline sono formate dalle catene lineari dell’amilopectina disposte a dare i polimorfi di tipo A, B o C, e si estendono per circa 6-7 nm, mentre le lamelle amorfe presentano la maggior parte dei punti di ramificazione e si estendono per circa 3 nm.[5]
Sintesi dell’amilopectina
La sintesi dell’amilopectina si ritiene avvenga a partire dall’ilo.[22]
La sintesi richiede l’intervento coordinato di almeno quattro distinte classi di enzimi: le amido sintasi, l’amido fosforilasi, gli enzimi ramificanti l’amido e gli enzimi deramificanti l’amido.[12] Ciascuna classe si compone di diverse isoforme con proprietà biochimiche distinte.
Al pari della sintesi dell’amilosio, anche per la sintesi dell’amilopectina sono necessari corti malto-oligosaccaridi o MOS, α-(1→4)-glucani lunghi da 2 a 7 residui glucosidici, che agiscono come primer e sono allungati dalle amido sintasi, una funzione analoga a quella svolta dalla proteina glicogenina nelle fasi iniziali della sintesi del glicogeno.[16]
I MOS sembra possano avere diverse origini, che chiamano tutte in causa enzimi coinvolti nella sintesi del granulo di amido, ossia:
- amido sintasi III e amido fosforilasi, quest’ultima in combinazione con l’enzima disproporzionate (EC 2.4.1.25), che utilizzano come substrati rispettivamente l’ADP-glucosio e il glucosio-1-fosfato;
- gli enzimi deramificanti l’amido, nel corso del rifinitura di altre molecole di amilopectina.[16]
Grazie alla loro scarsa solubilità in ambiente acquoso, i MOS sembrano in grado di eludere l’azione idrolitica delle alfa-amilasi (EC 3.2.1.1) e delle beta-amilasi (EC 3.2.1.2).
La coordinazione, sia spaziale che temporale, degli enzimi coinvolti, che in molti casi interagiscono anche fisicamente a formare complessi multienzimatici, è essenziale per permettere la conversione dei prodotti della fotosintesi nella struttura organizzata e insolubile del polisaccaride. E, come nel caso della sintesi dell’amilosio e del glicogeno, la polimerizzazione del glucosio in amilopectina, e più in generale di monosaccaridi osmoticamente attivi in polisaccaridi osmoticamente inerti, permette il deposito di grandi quantità di monosaccaridi all’interno della cellula senza alcun aumento sostanziale della pressione osmotica.
Amido sintasi
Sono note sei isoforme dell’amido sintasi, tutte strutturalmente correlate, di cui cinque sono coinvolte nella sintesi dell’amilopectina, isoforme indicate come amido sintasi I, II, III, IV e V o, rispettivamente, SSI, SSII, SSIII, SSIV e SSV (EC 2.4.1.21), presenti nello stroma dei plastidi o suddivise tra stroma e granuli, mentre la sesta, la amido sintasi legata ai granuli o GBSS (EC 2.4.1.242), è quasi esclusivamente legata ai granuli ed è coinvolta nella sintesi dell’amilosio.[10]
Le prime quattro isoforme sono dotate di attività catalitica e appartengono, come GBSS, la glicogeno fosforilasi (EC 2.4.1.1) e la glicogeno sintasi (EC 2.4.1.11), enzimi che intervengono rispettivamente nella glicogenolisi e nella sintesi del glicogeno, alla famiglia delle glicosiltransferasi (EC 2.4). La amido sintasi V è invece priva di attività catalitica.
Nel corso della sintesi dell’amilopectina, l’amido sintasi catalizza il trasferimento di un’unità di glucosio all’estremità non riducente di un α-(1→4)-glucano, cui il monosaccaride è legato per mezzo di un legame glicosidico α-(1→4).[5]
[(1→4)-alfa-D-glucosil](n) + ADP-alfa-D-glucosio ⇌ [(1→4)-alfa-D-glucosil](n+1) + ADP + H(+)
Si noti che, a differenza della glicogeno sintasi, le amido sintasi utilizzano come donatore dell’unità glucosidica l’ADP-glucosio e non l’UDP glucosio.
La modalità d’azione dell’amido sintasi I, II, III, e IV è differente rispetto a quella della GBSS in quanto sono in grado di catalizzare l’aggiunta di una sola unità di glucosio per incontro con il substrato, modalità d’azione definita distributiva, mentre l’amido sintasi legata ai granuli è in grado di catalizzare l’aggiunta di più di un’unità glucosidica per incontro con l’α-(1→4)-glucano nascente, modalità d’azione definita processuale.[17]
Ruolo delle amido sintasi
Le fasi iniziali della sintesi dell’amilopectina, nonché la formazione di un granulo di amido normale, richiedono la presenza di SSIV, sebbene anche SSIII sembra svolgere un ruolo, sovrapponendo la sua azione a quella di SSIV.[16]
Al pari della GBSS, SSIV richiede la presenza di PTST2, una proteina della famiglia PTST. PTST2 è priva di attività catalitica, ma è in grado, grazie alla presenza di uno specifico dominio che lega i carboidrati, di facilitare il legame dell’enzima agli alfa-glucani. SSIV è anche capace di formare dimeri, una caratteristica importante sia per l’attività catalitica che per la capacità di interagire con altre proteine.
Secondo un modello d’azione di PTST2, la proteina, a mezzo del dominio che lega i carboidrati, riconosce e forma un complesso con MOS dotati di una specifica forma tridimensionale elicoidale. In complesso proteina-MOS a sua volta interagisce con un dimero SSIV, che è ora in grado di catalizzare l’allungamento dell’alfa-glucano, mentre PTST2 viene rilasciata così da permetterle di legare un altro malto-oligosaccaride e facilitarne una successiva interazione con un altro dimero di SSIV.[15]
L’azione di SSIV è seguita da quella delle altre isoforme dell’amido sintasi. SSI catalizza l’allungamento di malto-oligosaccaridi lunghi da 6 a 7 residui glucosidici, a dare oligosaccaridi con un grado di polimerizzazione compreso tra 8 e 12, che a loro volta sono ottimi substrati per SSII, che porta il grado di polimerizzazione tra 12 e 30. Questi alfa-glucani sono ulteriormente allungati dall’azione catalitica di SSIII, a dare catene lineari con un grado di polimerizzazione superiore a 30.[12] Quindi SSIII sembra agire non solo nelle fasi iniziali della sintesi del granulo di amido, ma anche nelle fasi successive.
SSIV e SSV sembrano necessarie per la sintesi di un numero regolare di granuli di amido di normale morfologia.[1][16]
Enzimi ramificanti l’amido
Gli enzimi ramificanti l’amido catalizzano la formazione di legami glicosidici α-(1→6), creando quindi punti di ramificazione nella catena lineare di alfa-glucani, di cui i principali sono il glicogeno e l’amilopectina.[20] La loro azione aumenta il numero delle estremità non riducenti, che possono servire come accettori di unità glucosidiche nelle reazioni di allungamento.[14]
SBE catalizza dapprima la scissione idrolitica di un legame α-(1→4) all’interno di una catena di alfa-glucano, liberando un oligosaccaride la cui estremità riducente viene legata al gruppo idrossilico in posizione C6 di un’unità glucosidica di un alfa-glucano. Quindi le due catene sono legate a mezzo di un legame glicosidico α-(1→6).
La catena cui l’oligosaccaride viene legato può essere la stessa da cui è stato staccato, e in questo caso di parla di trasferimento intracatena, o una catena differente, e in questo caso si parla di trasferimento intercatena.
Tra i fattori determinanti il tipo di trasferimento sembra esserci la concentrazione relativa della catene lineari α-(1→4). In particolare sembra che le catena strettamente associate, come nelle doppie eliche che si formano nei cluster, promuovano il trasferimento inter-catena.[19] Infine sembra che l’interazione tra l’amido sintasi I e l’enzima ramificante sia cruciale nel determinare la distribuzione bimodale della lunghezza delle catene osservata negli amidi delle piante.
Isoforme degli enzimi ramificanti l’amido
Nelle piante sono presenti due isoforme dell’enzima ramificante l’amido, indicate come SBEI e SBEII.
Codificate da geni distinti, hanno proprietà biochimiche distinte, il che suggerisce che svolgano ruoli differenti nella determinazione della struttura dell’amilopectina e dell’amilosio.[17]
SBEI sembra essere espresso maggiormente nei tessuti di deposito, il che suggerisce un suo ruolo importante nel determinare le proprietà strutturali degli amidi di deposito, mostra una preferenza di substrato per l’amilosio, e in grado di trasferire oligosaccaridi con un grado di polimerizzazione superiore ai 30, sebbene la maggior parte sia tra 10 e 13.[6] Sembra inoltre intervenire nella formazione delle catene superlunghe ed extralunghe dell’amilopectina, mentre sembrano meno importanti altri suoi contributi alla struttura dell’amilopectina. Non tutte le piante esprimono SBEI; ad esempio Arabidopsis e Canola (Brassica napus L.), che immagazzinano olio, e dove l’amido è presente solo nei tessuti fotosintetici, hanno solo SBEII.
SBEII è maggiormente espresso nelle graminacee, nei cereali, e in molte altre piante. La sua perdita determina importanti alterazioni nell’architettura dell’amilopectina e influenza anche la quantità totale di amido, riducendone il contenuto. L’enzima mostra una preferenza di substrato per l’amilopectina e trasferisce oligosaccaridi relativamente corti, formati da 6-14 unità di glucosio. Nei cereali e nelle graminacee SBEII è presente con due isoforme tessuto-specifiche e codificate da geni distinti, indicate come SBEIIa, presente principalmente nelle foglie, e SBEIIb, presente prevalentemente nell’endosperma.[17]
Enzimi deramificanti l’amido
Gli enzimi deramificanti l’amido catalizzano l’idrolisi dei legami glicosidici α-(1→6), e appartengono alla superfamiglia delle alfa-amilasi.
Nelle piante sono presenti due tipi di enzimi deramificanti: le isoamilasi (EC 3.2.1.68) e le pullulanasi (EC 3.2.1.41).[8] Le isoamilasi deramificano l’amilopectina e altri poliglucani, mentre le pullulanasi l’amilopectina e il pullulano, un polisaccaride fungino. Isoamilasi e pullulanasi differiscono anche riguardo alla specificità di substrato in quanto le isoamilasi richiedono che le ramificazioni siano formate da almeno tre residui glucosidici, mentre le pullulanasi sono in grado di agire su ramificazioni con non meno di due residui glucosidici.[18]
Nel corso della formazione del granulo di amido gli enzimi deramificanti svolgono un ruolo cruciale nel determinare le proprietà insolubili e la struttura fine dell’amilopectina. Si ritiene infatti che le idrolisi operate permettano il raggruppamento delle ramificazioni rimanenti, promuovendo in questo modo le interazioni tra catene adiacenti e la formazione delle alfa-eliche, che a loro volta sono importanti nella formazione delle strutture semicristalline insolubili in acqua dell’amilopectina, e quindi dell’amido.[17] Nella struttura semicristallina le ramificazioni sono presumibilmente inaccessibili all’azione della alfa-amilasi e beta-amilasi e dell’enzima deramificante stesso.
Gli enzimi deramificanti l’amido sono utilizzati industrialmente nella preparazione dell’amido resistente e delle ciclodestrine, che sono oligosaccaridi ciclici.
Amido fosforilasi
L’amido fosforilasi appartiene, al pari delle amido sintasi, alla famiglia delle glicosiltransferasi, ed è una fosforilasi simile alla glicogeno fosforilasi. Nelle piante è presente con almeno due forme isoenzimatiche, Pho1, che si ritrova nello stroma dei plastidi, ed è considerata la vera amido fosforilasi che si ritiene agisca nella sintesi dell’amido, e Pho2, isoforma a localizzazione citosolica.[4]
L’amido fosforilasi sembra essere coinvolta nei passaggi iniziali della sintesi dell’amido, catalizzando il trasferimento, reversibile, di unità glucosidiche a un alfa-glucano, unità che sono legate attraverso un legame glicosidico α-(1→4).[3] A differenza delle amido sintasi, il substrato donatore dell’unità glucosidica è il glucosio-1-fosfato e non l’ADP-glucosio.[4]
Fosforilazione dell’amilopectina
L’amilopectina, analogamente al glicogeno, lega covalentemente gruppi fosfato in quantità variabili a seconda dell’origine botanica dell’amido. Ad esempio, l’amido delle patate ha un contenuto di gruppi fosfato relativamente alto, con un grado di sostituzione di circa lo 0,1-0,3%, mentre negli amidi di deposito dell’endosperma dei cereali è generalmente inferiore allo 0,01%.[9]
La fosforilazione dell’amilopectina è catalizzata da due dichinasi presenti nei plastidi: la alfa-glucano acqua dichinasi (EC 2.7.9.4) e la fosfoglucano acqua dichinasi (EC 2.7.9.5). I due enzimi catalizzano il trasferimento del gruppo fosfato beta dell’ATP a un residuo glucosidico di una di catena di alfa-glucano, mentre il gruppo fosfato gamma è trasferito all’acqua. Nello specifico, la alfa-glucano acqua dichinasi catalizza la fosforilazione del gruppo ossidrilico in posizione C6, mentre la fosfoglucano acqua dichinasi del gruppo ossidrilico in posizione C3, di solito di un alfa-glucano prefosforilato.[13] La posizione C6 raccoglie circa i due terzi dei gruppi fosfato, mentre la posizione C3 circa il 20-30%. Gruppi fosfato si ritrovano anche in posizione C2, sebbene in percentuale molto ridotta rispetto alle altre posizioni. Non è noto quale enzima catalizzi questa fosforilazione.
Riguardo alla specificità di substrato sembra che le fosforilazioni si accumulino più facilmente sulle catene più lunghe. Inoltre sembra esistere anche una correlazione inversa tra il contenuto totale di fosfato e la frequenza delle ramificazioni dell’amilopectina.
Le cariche negative portate dai gruppi fosfato determinano modificazioni localizzate della struttura del polisaccaride, in quanto tendono a far allontanare le une dalle altre le catene fosforilate adiacenti. Queste repulsioni sembra permettano l’apertura e l’idratazione delle catene, influenzando in questo modo l’attività degli enzimi della biosintesi e rendendo anche più suscettibili le catene stesse all’attacco delle amilasi.[21]
Rapporto amilosio/amilopectina
I granuli di amido sono costituiti per la maggior da amilosio e amilopectina.[12] I due polisaccaridi sono presenti in percentuali variabili, con l’amilosio che non costituisce più del 35% del peso secco del granulo.[5] Esistono tuttavia piante nelle quali i granuli di amido sono costituiti per la maggior parte, o quasi interamente, da amilopectina, amidi definiti cerosi, e altre dove, al contrario, l’amilosio costituisce la maggior parte, e in alcuni casi, la quasi totalità della componente polisaccaridica del granulo.[19]
Il rapporto amilosio/amilopectina influenza le proprietà fisico-chimiche dell’amido, quali la capacità di assorbire acqua, la gelatinizzazione e la retrogradazione, o la resistenza all’idrolisi enzimatica, quest’ultima importante nel determinare la velocità con cui, nel corso della digestione dei carboidrati, amilosio e amilopectina sono idrolizzati a maltosio e maltotriosio ad opera della alfa-amilasi.[3] Pertanto, il rapporto amilosio/amilopectina influenza gli effetti dei differenti tipi di amido sulla salute nonché i possibili usi industriali.
Bibliografia
- ^ a b Abt M.R., Pfister B., Sharma M., Eicke S., Bürgy L., Neale I., Seung D., Zeeman S.C. STARCH SYNTHASE5, a noncanonical starch synthase-like protein, promotes starch granule initiation in Arabidopsis. Plant Cell 2020;32(8):2543-2565. doi:10.1105/tpc.19.00946
- ^ a b Cornejo-Ramírez Y.I., Martínez-Cruz O., Del Toro-Sánchez C.L., Wong-Corral F.J., Borboa-Flores J. & Cinco-Moroyoqui F.J. The structural characteristics of starches and their functional properties. CYTA J Food 2018;16(1):1003-1017. doi:10.1080/19476337.2018.1518343
- ^ a b c d Crofts N., Abe N., Oitome N.F., Matsushima R., Hayashi M., Tetlow I.J., Emes M.J., Nakamura Y., Fujita N. Amylopectin biosynthetic enzymes from developing rice seed form enzymatically active protein complexes. J Exp Bot 2015;66(15):4469-82. doi:10.1093/jxb/erv212
- ^ a b Cuesta-Seijo J.A., Ruzanski C., Krucewicz K., Meier S., Hägglund P., Svensson B., Palcic M.M. Functional and structural characterization of plastidic starch phosphorylase during barley endosperm development. PLoS One 2017;12(4):e0175488. doi:10.1371/journal.pone
- ^ a b c Gous P.W., Fox G.P. Review: Amylopectin synthesis and hydrolysis – Understanding isoamylase and limit dextrinase and their impact on starch structure on barley (Hordeum vulgare) quality. Trends Food Sci Technol 2017;62:23-32. doi:10.1016/j.tifs.2016.11.013
- ^ Guan H.P., Preiss J. Differentiation of the properties of the branching isozymes from maize (Zea mays). Plant Physiol 1993;102(4):1269-1273. doi:10.1104/pp.102.4.1269
- ^ a b Li G., Yacine Y., Zhu F. Relationships between supramolecular organization and amylopectin fine structure of quinoa starch. Food Hydrocoll 2021;117:106685. doi:10.1016/j.foodhyd.2021.106685
- ^ Møller M.S., Henriksen A., Svensson B. Structure and function of α-glucan debranching enzymes. Cell Mol Life Sci. 2016;73(14):2619-41. doi:10.1007/s00018-016-2241-y
- ^ Nitschke F., Wang P., Schmieder P., Girard J.M., Awrey D.E., Wang T., Israelian J., Zhao X., Turnbull J., Heydenreich M., Kleinpeter E., Steup M., Minassian B.A. Hyperphosphorylation of glucosyl C6 carbons and altered structure of glycogen in the neurodegenerative epilepsy Lafora disease. Cell Metab 2013;17(5):756-67. doi:10.1016/j.cmet.2013.04.006
- ^ a b c d Pfister B., Zeeman S.C. Formation of starch in plant cells. Cell Mol Life Sci 2016;73(14):2781-807. doi:10.1007/s00018-016-2250-x
- ^ a b Pfister B., Zeeman S.C., Rugen M.D., Field R.A., Ebenhöh O., Raguin A. Theoretical and experimental approaches to understand the biosynthesis of starch granules in a physiological context. Photosynth Res 2020;145:55-70. doi:10.1007/s11120-019-00704-y
- ^ a b c d Qu J., Xu S., Zhang Z., Chen G., Zhong Y., Liu L., Zhang R., Xue J., Guo D. Evolutionary, structural and expression analysis of core genes involved in starch synthesis. Sci Rep 2018;8(1):12736. doi:10.1038/s41598-018-30411-y
- ^ Ritte G., Heydenreich M., Mahlow S., Haebel S., Kötting O., Steup M. Phosphorylation of C6- and C3-positions of glucosyl residues in starch is catalysed by distinct dikinases. FEBS Lett 2006;580(20):4872-6. doi:10.1016/j.febslet.2006.07.085
- ^ Sawada T., Nakamura Y., Ohdan T., Saitoh A., Francisco P.B. Jr, Suzuki E., Fujita N., Shimonaga T., Fujiwara S., Tsuzuki M., Colleoni C., Ball S. Diversity of reaction characteristics of glucan branching enzymes and the fine structure of α-glucan from various sources. Arch Biochem Biophys 2014;562:9-21. doi:10.1016/j.abb.2014.07.032
- ^ Seung D., Boudet J., Monroe J., Schreier T.B., David L.C., Abt M., Lu K.J., Zanella M., Zeeman S.C. Homologs of PROTEIN TARGETING TO STARCH control starch granule initiation in Arabidopsis leaves. Plant Cell 2017;29(7):1657-1677. doi:10.1105/tpc.17.00222
- ^ a b c d Szydlowski N., Ragel P., Raynaud S., Lucas M.M., Roldán I., Montero M., Muñoz F.J., Ovecka M., Bahaji A., Planchot V., Pozueta-Romero J., D’Hulst C., Mérida A. Starch granule initiation in Arabidopsis requires the presence of either class IV or class III starch synthases. Plant Cell 2009;21(8):2443-57. doi:10.1105/tpc.109.066522
- ^ a b c d e f g Tetlow I.J., Bertoft E. A review of starch biosynthesis in relation to the building block-backbone model. Int J Mol Sci 2020;21(19):7011. doi:10.3390/ijms21197011
- ^ Xia W., Zhang K., Su L., Wu J. Microbial starch debranching enzymes: developments and applications. Biotechnol Adv 2021;50(3):107786. doi:10.1016/j.biotechadv.2021.107786
- ^ a b Wang J., Hu P., Lin L., Chen Z., Liu Q., Wei C. Gradually decreasing starch branching enzyme expression is responsible for the formation of heterogeneous starch granules. Plant Physiol 2018;176(1):582-595. doi:10.1104/pp.17.01013
- ^ Wilkens C., Svensson B., Møller M.S. Functional roles of starch binding domains and surface binding sites in enzymes involved in starch biosynthesis. Front Plant Sci 2018;9:1652. doi:10.3389/fpls.2018.01652
- ^ Zhou W., He S., Naconsie M., Ma Q., Zeeman S.C., Gruissem W. & Zhang P. Alpha-glucan, water dikinase 1 affects starch metabolism and storage root growth in Cassava (Manihot esculenta Crantz). Sci Rep 2017;7:9863 doi:10.1038/s41598-017-10594-6
- ^ Ziegler G.R., Creek J.A., Runt J. Spherulitic crystallization in starch as a model for starch granule initiation. Biomacromolecules 2005;6(3):1547-54. doi:10.1021/bm049214p