Il ciclo di Cori fu scoperto negli anni 30 e 40 del secolo scorso dai coniugi Carl e Gerty Cori, i quali scoprirono l’esistenza di una cooperazione metabolica tra il muscolo scheletrico che lavora in condizioni di limitata disponibilità di ossigeno e il fegato.[1]
Il ciclo permette la conversione del lattato, la forma in cui l’acido lattico è quasi esclusivamente presente a pH fisiologico, in glucosio, assicurando così un continuo apporto del monosaccaride ai tessuti periferici. La sua importanza è testimoniata anche dal fatto che è responsabile di circa il 36% del turn over del glucosio plasmatico.[2][3]
Dal punto di vista biochimico, il ciclo di Cori connette la glicolisi anaerobica con la gluconeogenesi, utilizzando tessuti differenti per compartimentalizzare processi opposti.[4]
Questa cooperazione metabolica è stata dimostrata esistere anche tra il fegato e tessuti extraepatici diversi dal muscolo scheletrico. Si può infatti affermare che, come per il ciclo glucosio-alanina, al ciclo di Cori possono partecipare i tessuti che non ossidino completamente il glucosio a CO2 e H2O.[5]
Indice
- Via metabolica
- Costo energetico
- Il ciclo di Cori è un ciclo futile?
- Analogie con il ciclo glucosio-alanina
- Differenze con il ciclo glucosio-alanina
- Bibliografia
Via metabolica
Di seguito sono riassunte le tappe del ciclo di Cori, considerando il lattato prodotto dalle fibre muscolari o dal globulo rosso.
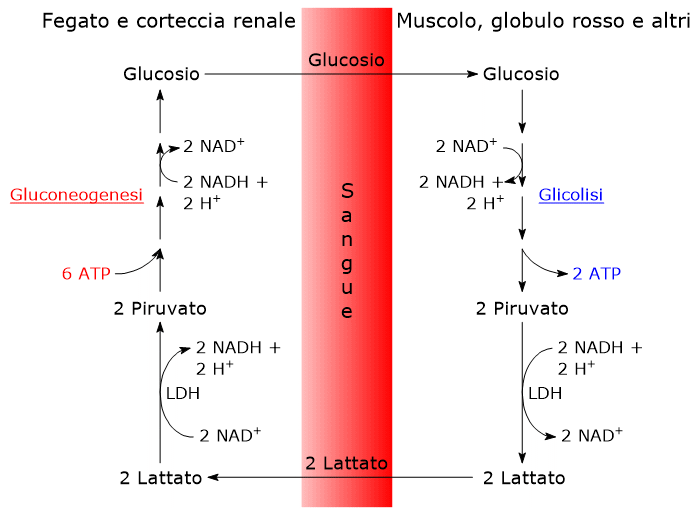
- Il ciclo ha inizio con la conversione del glucosio a lattato, attraverso la glicolisi anaerobica e la successiva azione della lattato deidrogenasi (EC 1.1.1.27), che catalizza la riduzione del piruvato, la base coniugata dell’acido piruvico.[6]
- Segue la diffusione del lattato dalla cellula al circolo sanguigno, grazie al quale raggiunge, tra gli altri, il fegato, che è il suo principale utilizzatore, e la corteccia renale, in particolare i tubuli prossimali, essendo questi un altro sito dove avviene la gluconeogenesi.[6]
- Nel fegato e nella corteccia renale si verifica l’ossidazione, catalizzata dalla lattato deidrogenasi, del lattato a piruvato, che è quindi convertito a glucosio a mezzo della via gluconeogenica.[7]
- Infine il glucosio prodotto diffonde nel circolo sanguigno, grazie al quale potrà raggiungere i globuli rossi o le fibre muscolari, chiudendo il ciclo.[8]
Globulo rosso
I globuli rossi, essendo privi di nucleo, ribosomi e mitocondri, sono più piccoli rispetto a molte altre cellule, e le ridotte dimensioni permettono loro il passaggio attraverso gli stretti capillari. Tuttavia la mancanza dei mitocondri li rende completamente dipendenti dalla glicolisi anaerobica per la produzione di ATP, il che significa che queste cellule producono continuamente acido lattico.[8]
La possibilità di procedere della glicolisi, come la sua velocità, dipendono anche dalla disponibilità di NAD+. Il coenzima nella sua forma ossidata è infatti necessario per l’ossidazione della gliceraldeide-3-fosfato a 1,3-bisfosfoglicerato nella reazione catalizzata dalla gliceraldeide-3-fosfato deidrogenasi (EC 1.2.1.12).[3]
Gliceraldeide-3-fosfato + NAD+ → 1,3-Bisfosfoglicerato + NADH + H+
L’accumulo di NADH è evitato dalla riduzione del piruvato a lattato, in una reazione catalizzata dalla lattato deidrogenasi nella quale il NADH funge da donatore di agenti riducenti, ossidandosi a NAD+.[9][10]
Fibre muscolari
Le fibre muscolari a contrazione rapida contengono un numero ridotto di mitocondri e, in condizioni di limitata disponibilità di ossigeno, come durante un lavoro intenso, producono notevoli quantità di acido lattico.[3] In queste condizioni infatti:
- la velocità di produzione del piruvato attraverso la via glicolitica eccede la capacità del ciclo dell’acido citrico di ossidarlo, tanto che meno del 10% del piruvato prodotto entra nel ciclo stesso;[7]
- la velocità alla quale l’ossigeno è assunto dalle cellule non è sufficiente ad assicurare l’ossidazione aerobica di tutto il NADH formato.[11]
In tali condizioni la glicolisi anaerobica porta alla produzione di 2 molecole di ATP per molecola di glucosio, 3 se il glucosio proviene dal glicogeno muscolare, una quantità decisamente inferiore rispetto alle 29–30 molecole di ATP prodotte dalla completa ossidazione del glucosio.[10] Tuttavia la velocità con cui l’ATP è prodotto dalla glicolisi anaerobica è molto maggiore rispetto a quella ottenibile dalla completa ossidazione del glucosio.[8]
Infine, come nel globulo rosso, la reazione catalizzata dalla lattato deidrogenasi, rigenerando NAD+, permette alla glicolisi di procedere, ma produce lattato.[3]
Lattato
L’acido lattico è un prodotto finale del metabolismo, e per essere utilizzato dalla cellula deve essere convertito in piruvato.[7]
La membrana plasmatica della maggior parte delle cellule è liberamente permeabile sia al piruvato che al lattato, che possono quindi raggiungere il circolo ematico.[12] Considerando ad esempio il muscolo scheletrico, la quantità di lattato che lascia la cellula è maggiore rispetto a quella del piruvato grazie all’elevato rapporto NADH/NAD+ intracellulare e alle proprietà catalitiche dell’isoenzima muscolare della lattato deidrogenasi.[13]
Una volta in circolo il lattato raggiunge, tra gli altri, il fegato e la corteccia renale, dove viene ossidato a piruvato, nella reazione catalizzata dagli specifici isoenzimi della lattato deidrogenasi.[14]
Negli epatociti questa ossidazione è favorita dal basso rapporto NADH/NAD+ presente nel citosol. Il piruvato è quindi disponibile per entrare nella tappa successiva del ciclo di Cori, la gluconeogenesi.[7]
Il glucosio prodotto, tramite il circolo ematico raggiunge il muscolo e il globulo rosso, chiudendo così il ciclo. Ovviamente il monosaccaride raggiungerà anche tutti gli altri tessuti e cellule che lo richiedono.[15]
Costo energetico
Il ciclo di Cori comporta un consumo netto di 4 molecole di ATP per ciclo.
La parte del ciclo che comprende la gluconeogenesi consuma 6 equivalenti di ATP, nello specifico 4 ATP e 2 GTP, nelle reazioni catalizzate dagli enzimi:
- piruvato carbossilasi (EC 6.4.1.1): un ATP;
- fosfoenolpiruvato carbossichinasi (EC 4.1.1.32): un GTP;
- gliceraldeide-3-fosfato deidrogenasi: un ATP.
Poiché sono utilizzate due molecole di lattato per la sintesi di ogni molecola di glucosio, il costo totale è di 2 x 3 = 6 legami ad alta energia per molecola di glucosio.
Di contro, la parte del ciclo che comprende la glicolisi anaerobica ne produce 2.
In definitiva, è richiesta più energia per produrre glucosio dall’acido lattico nel fegato e nella corteccia renale rispetto a quella ottenuta dall’ossidazione anaerobica del glucosio nei tessuti extraepatici. Questo spiega perché il ciclo di Cori non può essere sostenuto indefinitamente.[15]
Il ciclo di Cori è un ciclo futile?
La demolizione e risintesi del glucosio caratteristica del ciclo di Cori può sembrare uno spreco di energia. In realtà questo ciclo permette l’efficace funzionamento di numerose cellule extraepatiche a spese del fegato e della corteccia renale, ed è quindi forse più corretto definirlo ciclo del substrato piuttosto che ciclo futile.[8]
Di seguito alcuni esempi.
- Il ciclo di Cori contribuisce allo smaltimento di parte dell’acido lattico che i globuli rossi producono.[3]
- Se si considera il muscolo scheletrico, la glicolisi anaerobica rappresenta una efficiente sorgente di ATP nel corso di un esercizio intenso. Ma questo potrebbe portare a un accumulo intracellulare di lattato, e a una pericolosa diminuzione del pH intracellulare. Questo accumulo è ampiamente prevenuto dal ciclo di Cori, in cui i tessuti gluconeogenici, principalmente fegato e corteccia renale, sostengono il costo energetico della rimozione del lattato muscolare in eccesso.[16]
Inoltre, il debito di ossigeno contratto dopo un esercizio intenso è in gran parte dovuto all’aumentata richiesta di ossigeno degli epatociti, dove l’ossidazione degli acidi grassi, il loro combustibile primario, fornisce l’ATP necessario per la gluconeogenesi.[15][17] - Nel corso di traumi, sepsi, ustioni, o dopo grossi interventi chirurgici, si verifica un’intensa proliferazione cellulare nelle ferite, che sono tessuti ipossici, e nel midollo osseo. Questo a sua volta risulta in una maggiore produzione di acido lattico e un aumento del flusso attraverso il ciclo di Cori e, a livello epatico, in un consumo di ATP.[18] Come già accennato, questa richiesta viene soddisfatta attraverso un’aumentata ossidazione degli acidi grassi. Una situazione simile sembra presentarsi anche in quei pazienti oncologici che vanno incontro a una progressiva perdita di peso.[19]
- Il ciclo di Cori svolge un ruolo importante anche durante il digiuno notturno e la fame in quanto concorre alla regolazione della glicemia.[5][17]
Analogie con il ciclo glucosio-alanina
- Il ciclo glucosio-alanina e quello di Cori sono vie metaboliche che si estendono attraverso tipi cellulari differenti e contribuiscono ad assicurare un continuo rifornimento di glucosio ai tessuti peroiferici.
- In entrambe i cicli l’ingresso nella gluconeogenesi comporta la conversione del lattato e dell’alanina in piruvato.
- Infine, in entrambe, il glucosio prodotto è quindi trasportato ai tessuti periferici dove la via glicolitica rigenera piruvato.[15]
Differenze con il ciclo glucosio-alanina
La loro principale differenza tra i due cicli consiste nell’intermedio a tre atomi di carbonio che viene riciclato:
- nel ciclo di Cori il carbonio torna al fegato in forma di piruvato;
- nel ciclo glucosio-alanina in forma di alanina.[20]
I cicli differiscono anche per il destino metabolico del NADH:
- nel ciclo di Cori il NADH funge da agente riducente nella reazione catalizzata dalla lattato deidrogenasi;
- nel ciclo glucosio-alanina gli elettroni del coenzima sono utilizzati per la sintesi di ATP nei mitocondri.[15]
Da ciò consegue anche che un’altra differenza fondamentale è che il ciclo glucosio-alanina richiede ossigeno, mentre il ciclo di Cori può funzionare in condizioni anaerobiche.[3]
| Caratteristica | Ciclo di Cori | Ciclo Glucosio-Alanina |
|---|---|---|
| Trasportatore del carbonio | Lattato | Alanina |
| Intermedio che torna al fegato | Piruvato (tramite lattato) | Piruvato (tramite alanina) |
| Destino del NADH | Riossidato a NAD⁺ dalla LDH | Utilizzato nei mitocondri per generare ATP |
| Richiesta di ossigeno | No | Sì |
| Principale contesto di attivazione | Esercizio intenso, globuli rossi | Catabolismo delle proteine muscolari, digiuno prolungato |
| Funzione aggiuntiva | Previene l’accumulo di lattato e l’acidosi | Trasporta azoto per la sintesi dell’urea |
Bibliografia
- ^ American Chemical Society National Historic Chemical Landmarks. Carl and Gerty Cori and Carbohydrate Metabolism. https://www.acs.org/education/whatischemistry/landmarks/carbohydratemetabolism.html. Accessed June 27, 2025.
- ^ Katz J., Tayek J.A. Gluconeogenesis and the Cori cycle in 12-, 20-, and 40-h-fasted humans. Am J Physiol 1998;275(3):E537-42. doi:10.1152/ajpendo.1998.275.3.E537
- ^ a b c d e f Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012.
- ^ Rodwell V.W., Bender D.A., Botham K.M., Kennelly P.J., Weil P.A. Harper’s Illustrated Biochemistry. 31st Edition. McGraw-Hill, 2018.
- ^ a b Rui L. Energy metabolism in the liver. Compr Physiol 2014;4(1):177-97. doi:10.1002/cphy.c130024
- ^ a b Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 3rd Edition. Elsevier health sciences, 2012.
- ^ a b c d Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5th Edition. W. H. Freeman and Company, 2002.
- ^ a b c d Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publication, 2009.
- ^ Spinelli S., Marino A., Morabito R., Remigante A. Interplay between metabolic pathways and increased oxidative stress in human red blood cells. Cells 2024;13(23):2026. doi:10.3390/cells13232026
- ^ a b Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010.
- ^ Rich P.R. The molecular machinery of Keilin’s respiratory chain. Biochem Soc Trans 2003;31(Pt 6):1095-105. doi:10.1042/bst0311095
- ^ Halestrap A.P. The monocarboxylate transporter family — Structure and functional characterization. IUBMB Life 2012;64(1):1-9. doi:10.1002/iub.573
- ^ Gleeson T.T. Post-exercise lactate metabolism: a comparative review of sites, pathways, and regulation. Annu Rev Physiol 1996;58:565-81. doi:10.1146/annurev.ph.58.030196.003025
- ^ Gladden L.B. Lactate metabolism: a new paradigm for the third millennium. J Physiol 2004;558(Pt 1):5-30. doi:10.1113/jphysiol.2003.058701
- ^ a b c d e Voet D. and Voet J.D. Biochemistry. 4th Edition. John Wiley J. & Sons, Inc. 2011.
- ^ van Hall G. Lactate kinetics in human tissues at rest and during exercise. Acta Physiol (Oxf) 2010;199(4):499-508. doi:10.1111/j.1748-1716.2010.02122.x
- ^ a b Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012.
- ^ Liu S., Yang T., Jiang Q., Zhang L., Shi X., Liu X., Li X. Lactate and lactylation in sepsis: a comprehensive review. J Inflamm Res 2024;17:4405-4417. doi:10.2147/JIR.S459185
- ^ Li X., Yang Y., Zhang B., Lin X., Fu X., An Y., Zou Y., Wang J.X., Wang Z., Yu T. Lactate metabolism in human health and disease. Signal Transduct Target Ther 2022;7(1):305. doi:10.1038/s41392-022-01151-3
- ^ Felig P., Pozefsk T., Marlis E., Cahill G.F. Alanine: key role in gluconeogenesis. Science 1970;167(3920):1003-1004. doi:10.1126/science.167.3920.1003