L’organismo necessita di proteine, in particolare degli aminoacidi essenziali in esse contenuti.
L’assunzione giornaliera raccomandata è pari a 0,9 g/kg di peso corporeo desiderabile, quindi per un adulto di 70 kg circa 63 g, ma spesso nella tipica dieta occidentale se ne possono assumere più di 100 g/d.
Oltre alle proteine di origine alimentare, la digestione delle proteine interessa anche 50-100 g di proteine endogene che sono secrete o perse nel lume del tratto gastrointestinale, e che derivano da:
- saliva;
- succo gastrico;
- enzimi pancreatici e altre secrezioni;
- cellule intestinali che si sfaldano;
- proteine che passano nel lume intestinale dal circolo ematico.
Questa miscela è efficientemente digerita e assorbita nel duodeno, la parte più alta del piccolo intestino, con perdite giornaliere con le feci pari a circa 1,6 g di azoto, equivalente a 10 g di proteine. La maggior parte dell’azoto perduto è utilizzato nel colon dal microbiota intestinale per la propria crescita, e quindi sarà presente nelle feci come parte della massa batterica.
Indice
Enzimi coinvolti
La digestione delle proteine si verifica a seguito dell’idrolisi dei legami peptidici che legano i singoli aminoacidi nella catena polipeptidica, in reazioni catalizzate da enzimi detti proteasi.
Le proteasi intestinali, specifiche per la catena laterale degli aminoacidi, sono idrolasi che possono essere distinte in due classi:
- endopeptidasi, che idrolizzano legami peptidici all’interno della catena polipeptidica, e sono prodotte dallo stomaco e dal pancreas esocrino;
- esopeptidasi, di cui ne esistono due gruppi:
le carbossipeptidasi, che rimuovono aminoacidi dall’estremità C-terminale dei peptidi, e sono prodotte dal pancreas esocrino;
le aminopeptidasi, che agiscono sull’estremità N-terminale dei peptidi, e sono prodotte dagli enterociti.
| Sito di sintesi | Zimogeno | Enzima attivo |
|---|---|---|
| Stomaco | Pepsinogeno | Pepsina |
| Pancreas | Chimotripsinogeno | Chimotripsina |
| Pancreas | Tripsinogeno | Tripsina |
| Pancreas | Procarbossipeptidasi A e B | Carbossipeptidasi A e B |
| Pancreas | Proelastasi | Elastasi |
| Pancreas | Prolipasi | Lipasi |
Questi enzimi sono sintetizzati e secreti in forma inattiva, e in questa forma sono detti zimogeni o proenzimi.
All’interno della cellula gli zimogeni sono concentrati in vescicole delimitate da membrane chiamate granuli di zimogeno. Una volta che la cellula è stimolata dallo specifico segnale, la membrana del granulo si fonde con quella plasmatica e gli zimogeni sono rilasciati per esocitosi.
La sintesi in forma inattiva delle proteasi intestinali è essenziale per evitare che prima di essere secrete si autodigeriscano e/o attacchino le proteine tissutali. Quello che accade è che il sito attivo dell’enzima viene “nascosto” e solo dopo l’attivazione la proteina stessa potrà andare ad agire sul substrato. L’attivazione è conseguenza dell’idrolisi, catalizzata da uno specifico enzima, di uno o più legami peptidici specifici, con rilascio di uno o più segmenti della catena polipeptidica; ciò permette alla molecola di assumere una conformazione tridimensionale nella quale il sito attivo è libero e correttamente configurato.
Anche il loro accumulo all’interno dei granuli è un sistema di protezione in quanto li isola dalle altre molecole presenti.
La maggior parte delle proteine nella loro conformazione nativa è resistenti all’azione delle proteasi. Questo è una conseguenza della loro struttura secondaria e terziaria o nativa che “nasconde” molti legami all’azione degli enzimi stessi. Queste strutture sono mantenute, oltre che da legami covalenti come i ponti disolfuro tra residui di cisteina, da forze non covalenti quali interazioni ioniche, legami idrogeno e forze di van der Waals.
Per la corretta digestione delle proteine è dunque essenziale che i legami peptidici siano il più possibile accessibili all’azione delle specifiche proteasi intestinali. Ciò è ottenuto, al di fuori dell’organismo attraverso la cottura dei cibi, e all’interno dell’organismo dall’ambiente acido che le proteine incontrano a livello gastrico.
Ruolo della cottura e masticazione degli alimenti
La cottura degli alimenti facilita, quando non è eccessiva, la digestione delle proteine.
In che modo?
Al pari di tutte le molecole, anche le proteine non sono immobili ma vibrano. Man mano che la temperatura aumenta anche le vibrazioni aumentano, fino a distruggere i legami non covalenti che concorrono al mantenimento della struttura nativa. Si verifica quindi un cambiamento conformazionale delle proteine stesse, ossia la molecola si denatura, e questo può rendere più accessibili i legami peptidici interni all’attacco degli enzimi idrolitici.
Anche la masticazione e la conseguente insalivazione degli alimenti omogeneizza e umidifica i componenti solidi del cibo stesso, facilitando i processi idrolitici intestinali.
Fasi
Nella digestione intestinale delle proteine si possono individuare due fasi: la prima si verifica nello stomaco e l’altra nel duodeno, la prima parte del piccolo intestino.
Fase gastrica
La digestione delle proteine ha inizio nello stomaco, che ha un ruolo preparatorio rispetto agli eventi che si verificheranno nel duodeno.
La presenza del cibo nello stomaco stimola la secrezione in circolo da parte delle cellule G della mucosa dell’antro gastrico e della porzione prossimale del duodeno della gastrina, un ormone peptidico. L’ormone stimola le cellule parietali delle ghiandole gastriche propriamente dette, localizzate per la maggior parte nel fondo dell’organo, a produrre e secernere nello stomaco acido cloridrico. Le cellule parietali producono anche il fattore intrinseco, una proteina che lega la vitamina B12, impedendone la distruzione e consentendone il successivo assorbimento.
Nelle ghiandole gastriche sono presenti anche:
- le cellule mucose del colletto che producono muco;
- le cellule principali che rilasciano il pepsinogeno.
Tutte queste sostanze, assieme ad altre come lo ione potassio e la lipasi gastrica, si vengono a ritrovare nel succo gastrico, che ha un pH compreso tra 1 e 2,5.
Grazie al suo basso pH il succo gastrico ha un’azione antisettica, uccidendo la maggior parte dei batteri e delle altre cellule estranee, e denaturante in quanto rompe i legami non covalenti che mantengono la struttura nativa della proteine, e questo, come detto in precedenza, al pari del riscaldamento facilita l’accesso delle proteasi intestinali ai legami peptidici. Alcune proteine ricche di ponti disolfuro, come le cheratine, sono resistenti a questa denaturazione, e dunque difficili da digerire; al contrario la maggior parte delle proteine globulari sono quasi interamente idrolizzate negli aminoacidi costituenti.
Infine il basso pH del succo gastrico attiva il pepsinogeno, uno zimogeno, a pepsina, il primo enzima a entrare in azione nella digestione delle proteine.
Pepsina
Sono prodotti diversi isoenzimi del pepsinogeno, come il tipo I, sintetizzato dalle cellule del corpo e del fondo dello stomaco, e il tipo II che invece è prodotto in tutto lo stomaco. Ognuno è convertito nell’enzima attivo.
L’attivazione si verifica per autocatalisi, a valori di pH inferiori a 5, tramite un processo intramolecolare che consiste nell’idrolisi di un legame peptidico specifico con distacco di un piccolo peptide dall’estremità N-terminale del proenzima. Il peptide rimane legato all’enzima e continua ad agire come inibitore fino a che il pH non scende sotto i 2 o finché non è ulteriormente degradato dalla pepsina stessa. Dunque, quando le condizioni sono favorevoli si viene a formare un po’ di pepsina, che a sua volta andrà ad attivare altre molecole di pepsinogeno con un ritmo esponenziale.
La pepsina, una endopeptidasi con un pH ottimale di azione pari a 1,6, idrolizza il 10-20% delle proteine presenti nel pasto. Molti enzimi digestivi sono in grado di agire su un ampio range di substrati, e le pepsine non fanno eccezione, idrolizzando i legami peptidici in corrispondenza di residui aminoacidici quali leucina e aminoacidi aromatici, fenilalanina, tirosina e triptofano. Il risultato della loro azione sono peptidi di dimensioni relativamente elevate e qualche aminoacido libero.
L’azione dell’enzima è importante non tanto per il suo contributo diretto alla demolizione delle proteine, che come visto è modesto, quanto per la formazione di peptidi e aminoacidi che a livello duodenale andranno a stimolare il rilascio di colecistochinina, e dunque la fase duodenale/pancreatica della digestione delle proteine.
Nota: l’azione della pepsina sul collagene, le proteine che avvolgono e tengono unite le cellule muscolari, facilita il successivo accesso delle proteasi pancreatiche alle altre proteine del pasto.
Fase duodenale
Quando il contenuto gastrico passa nel duodeno la sua acidità determina la secrezione in circolo da parte delle cellule S, localizzate nella mucosa del duodeno e della parte prossimale del digiuno, il tratto successivo del piccolo intestino, il digiuno, dell’ormone secretina.
La secretina stimola la secrezione di un succo pancreatico alcalino, in quanto ricco di bicarbonato, e povero di enzimi, che attraverso il dotto pancreatico raggiunge il duodeno dove neutralizza l’acido cloridrico di origine gastrica, portando il pH rapidamente intorno a 7. L’ormone stimola anche la secrezione della bile e riduce il rilascio di gastrina.
La presenza aminoacidi nel duodeno porta, come detto, al rilascio in circolo di colecistochinina o CCK da parte di cellule endocrine presenti lungo il duodeno e il digiuno. L’ormone, tra le altre funzioni, stimola la secrezione di un succo pancreatico ricco di diversi enzimi, prodotti e secreti in forma di zimogeni dal pancreas esocrino; nello specifico:
- tripsinogeno, chimotripsinogeno e proelastasi, endopeptidasi che hanno specificità diversa dalla pepsina e anche tra di loro;
- procarbossipeptidasi A e B, esopeptidasi che staccano un aminoacido alla volta dal C-terminale dei peptidi.
Nel duodeno si viene così a creare un ambiente neutro e ricco di enzimi in grado di proseguire, una volta attivati, la digestione delle proteine. Inoltre, essendo differente la specificità per il substrato, ogni peptide prodotto da un enzima può essere substrato di un altro.
Nel succo pancreatico sono presenti anche alfa-amilasi, nucleasi e la lipasi.
Attivazione degli zimogeni pancreatici
Il primo e più importante passo nella loro attivazione è la conversione del tripsinogeno a tripsina catalizzata da una endopeptidasi secreta dalle cellule dell’epitelio duodenale sotto stimolazione della colecistochinina, la enteropeptidasi, anche detta enterochinasi. L’enzima idrolizza uno specifico legame tra un residuo di lisina e uno di isoleucina del tripsinogeno, con distacco di un esapeptide che causa un riarrangiamento conformazionale della proteina in conseguenza del quale la stessa diviene attiva, ossia si forma la tripsina.
La tripsina idrolizza il legame peptidico in corrispondenza di residui di lisina e arginina, e, oltre ad agire sulle proteine da digerire, è in grado di attivare altre molecole di tripsinogeno, in modo simile alla pepsina, ma anche il chimotripsinogeno, la proelastasi e le procarbossipeptidasi A e B.
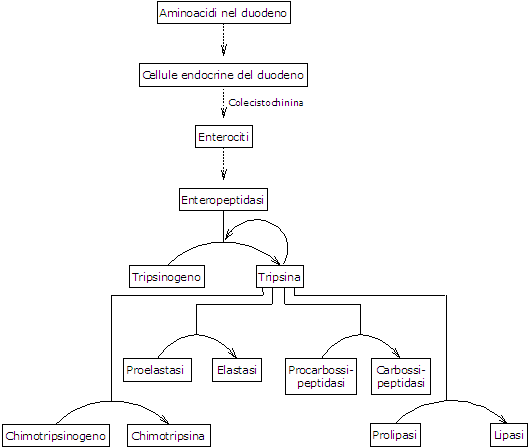
Quello che accade quindi è che la capacità del duodeno di digerire la proteine aumenta man mano che i vari zimogeni sono attivati, il tutto innescato da una piccola quantità di enteropeptidasi.
- Il chimotripsinogeno viene attivato in diversi stadi nei quali interviene la tripsina e di seguito la stessa chimotripsina.
Dapprima la tripsina attiva il chimotripsinogeno a pi-chimotripsina, che è completamente attiva. Poi la pi-chimotripsina catalizza il distacco di due dipeptidi con formazione della delta-chimotripsina, una forma più stabile dell’enzima, che subisce due cambiamenti conformazionali, il primo dei quali porta alla formazione della kappa-chimotripsina e il secondo della alfa-chimotripsina, la forma finale attiva.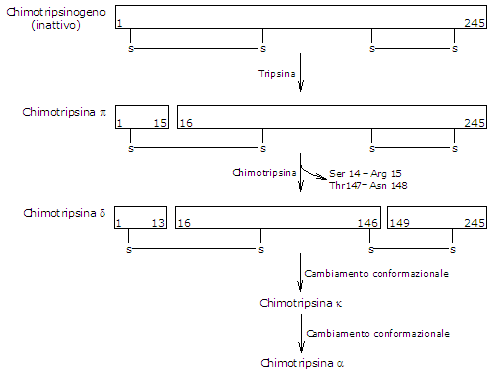
Attivazione del Chimotripsinogeno La chimotripsina agisce in corrispondenza di residui di fenilalanina, triptofano, metionina, tirosina e leucina.
- La proelastasi è attivata a seguito della rimozione di un piccolo peptide dalla regione N-terminale.
L’elastasi, che è meno specifica delle precedenti, idrolizza il legame peptidico in corrispondenza di aminoacidi come glicina, alanina e serina. - Procarbossipeptidasi
La procarbossipeptidasi A viene attivata a carbossipeptidasi A che è specifica per gli aminoacidi con catene laterali aromatiche o ramificate, come fenilalanina e valina.
La procarbossipeptidasi B è attivata a carbossipeptidasi B, specifica per aminoacidi con catene laterali basiche, come lisina e arginina.
Le proteasi suddette, a differenza della pepsina, hanno un pH ottimale di azione neutro o debolmente alcalino, compreso tra 7 e 8.
Inibitore pancreatico della tripsina
Esiste un sistema di protezione “supplementare” nei confronti di un’azione intrapancreatica della tripsina: la sintesi di un inibitore chiamato inibitore pancreatico della tripsina.
La molecola, presente all’interno dei granuli di zimogeno pancreatici, ha la capacità di legarsi molto saldamente al sito attivo dell’enzima inattivandolo. In questo modo si viene a bloccare l’attività di qualsiasi molecola di tripsina che possa formarsi da una prematura attivazione del tripsinogeno, prevenendo una situazione in cui poche molecole attive vadano ad attivare l’intero gruppo di zimogeni pancreatici.
Nei vegetali sono presenti molte molecole con attività simile. Un esempio è l’inibitore di Kunitz, una proteina, presente principalmente nella soia, che forma un complesso molto stabile con il sito attivo della tripsina.
Dato che le proteasi suddette vanno a tagliare in corrispondenza di aminoacidi differenti, ogni peptide prodotto da un enzima può essere substrato di un altro. In questo modo il materiale proteico in arrivo dallo stomaco è efficacemente idrolizzato a formare aminoacidi liberi e piccoli peptidi di 2-8 residui su cui vanno ad agire anche le aminopeptidasi secrete dagli enterociti e legate ai loro microvilli. Sono presenti anche dipeptidasi.
Infine va notato che le stesse proteasi saranno alla fine digerite, ponendo fine al processo.
L’importanza e l’efficacia degli enzimi proteolitici intestinali nella digestione delle proteine assunte con gli alimenti si può capire da questo esempio. Se in laboratorio si vuol idrolizzare delle proteine negli aminoacidi costituenti è necessario utilizzare un acido forte come catalizzatore e il riscaldamento del campione a 105 °C per tutta la notte. Nel intestino si ottiene lo stesso risultato lavorando prima in un ambiente relativamente acido, lo stomaco, poi debolmente alcalino, il duodeno, a 37 °C, e completando il tutto in poche ore.
Gli aminoacidi liberati, insieme a di- e tripeptidi, possono essere assorbiti dagli enterociti. I di- e tripeptidi sono in genere idrolizzati negli aminoacidi costituenti all’interno degli enterociti, e questo spiega perché nel circolo portale si ritrovano in pratica solo aminoacidi liberi.
Bibliografia
- Bender D.A. Benders’ dictionary of nutrition and food technology. 8th Edition. Woodhead Publishing. Oxford, 2006
- Bender D.A. Introduction to nutrition and metabolism. 3rd Edition. Taylor & Francis, 2004
- Bhagavan N.V., Ha C-E. Essentials of medical biochemistry: with clinical cases. 4th Edition. Academic Press, 2011. doi:10.1016/C2009-0-00064-6
- Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- Rosenthal M.D., Glew R.H. Medical Biochemistry: human metabolism in health and disease. John Wiley & Sons, INC., Publication, 2009
- Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 3rd Edition. Elsevier health sciences, 2012