La sintesi del glicogeno, o glicogenosintesi, è la fase anabolica o costruttiva del metabolismo del glicogeno.
Segue una via metabolica diversa da quella della sua degradazione, la glicogenolisi, ha la funzione di ripristinare le riserve di glicogeno nel fegato e nel muscolo, e si verifica quando sono disponibili carboidrati.
Nel fegato avviene nello stato alimentato ed è stimolata sia dalla aumentata disponibilità di glucosio che dall’insulina.
Nel muscolo nel post-esercizio è più rapida quando i livelli ematici di glucosio sono alti ed è disponibile insulina che va a stimolare sia il trasporto del glucosio nella cellula muscolare, grazie alla mobilizzazione degli specifici trasportatori detti GLUT4, che all’attività della glicogeno sintasi (EC 2.4.1.11).
La sintesi del glicogeno richiede un apporto energetico maggiore rispetto a quello che si recupera durante la sua degradazione. Sono infatti consumate due molecole di ATP contro una sola molecola recuperata grazie alla liberazione di glucosio-1-fosfato. Quindi il costo energetico pagato dalla cellula per immagazzinare il glucosio in forma di glicogeno è un legame ad alta energia per ogni molecola di glucosio.
Indice
Tappe della sintesi del glicogeno
Il primo passaggio è l’attivazione del glucosio a glucosio-6-fosfato nella reazione catalizzata dalla glucochinasi (EC 2.7.1.2) nel fegato e dalla esochinasi (EC 2.7.1.1) nel muscolo e negli altri organi e tessuti.
glucosio + ATP → glucosio-6-fosfato + ADP
Quando è in corso la sintesi del glicogeno, lo stesso enzima che agisce nella glicogenolisi catalizzando al conversione del glucosio-1-fosfato a glucosio-6-fosfato, sposta il gruppo fosfato da C6 a C1 (quindi l’enzima catalizza una reazione reversibile).
glucosio-6-fosfato ↔ glucosio-1-fosfato
Il passaggio successivo è la sintesi dell’UDP-glucosio dal glucosio-1-fosfato e UTP nella reazione catalizzata dalla UDP-glucosio pirofosforilasi (EC 2.7.7.9). La reazione è reversibile, e il nome dell’enzima è dovuto proprio alla reazione inversa, è resa irreversibile dalla rapida idrolisi del pirofosfato a fosfato inorganico nella reazione catalizzata dalla pirofosfatasi (EC 3.6.1.1).
Glucosio-1-fosfato + UTP → UDP-glucosio + PPi
PPi + H2O → 2 Pi
Da notare che sino ad ora sono state utilizzate due molecole di ATP per ogni molecola di glucosio attivata ad UDP-glucosio: una per la sintesi del glucosio-1-fosfato e l’altra per la risintesi dell’UTP dall’UDP nella reazione catalizzata dalla nucleoside disfosfato chinasi (EC 2.7.4.6).
UDP + ATP → UTP + ADP
Di seguito la glicogeno sintasi trasferisce lo zucchero attivato al gruppo 4′-idrossilico di un residuo di glucosio (una estremità non riducente) della molecola catalizzando la formazione di un legame glicosidico α-(1→4), allungando la catena di un’unità di glucosio. La glicogeno sintasi appartiene alla famiglia delle glicosiltransferasi (EC 2.4), al pari delle amido sintasi e dell’amido fosforilasi (EC 2.4.1.1), enzimi coinvolti nella sintesi dell’amilosio e dell’amilopectina, i due polisaccaridi che compongono l’amido.
L’equazione complessiva bilanciata per la sintesi del glicogeno è:
glicogeno(n residui di glucosio) + glucosio + 2 ATP → glicogeno(n+1 residui di glucosio) + 2 ADP + 2 Pi
Le ramificazioni sono inserite nella reazione catalizzata dall’enzima ramificante, detto amilo-α-(1,4)→α-(1,6)-transglicosidasi (EC 2.4.1.18). L’enzima trasferisce in blocco un oligosaccaride, formato da 6-7 residui, da un’estremità non riducente di una catena neosintetizzata di almeno 11 residui su un’altra catena formando un nuovo legame glicosidico α-(1,6).
Le nuove ramificazioni sono inserite ad almeno 4 residui di distanza dal punto di ramificazione più vicino.
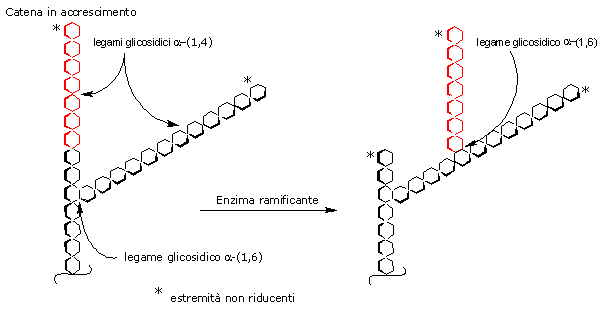
Di seguito la glicogeno sintetasi può aggiungere ulteriori residui di glucosio alla nuova catena.
Bibliografia
- Adeva-Andany M.M., González-Lucán M., Donapetry-García C., Fernández-Fernández C., Ameneiros-Rodríguez E. Glycogen metabolism in humans. BBA Clin 2016;5:85-100. doi:10.1016/j.bbacli.2016.02.001
- Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 3rd Edition. Elsevier health sciences, 2012