In una soluzione, le molecole di solvente tendono a spostarsi dalla regione dove la loro concentrazione è maggiore verso quella a concentrazione minore. Se si considerano due soluzioni separate da una membrana semipermeabile, ossia una membrana che consenta il passaggio solo a certi ioni o molecole, in questo caso le molecole di solvente, si verrà a creare attraverso la membrana un flusso netto di molecole di solvente dalla soluzione a concentrazione maggiore di solvente verso quella a concentrazione minore. Questo porta allo sviluppo di una pressione detta pressione osmotica, indicata con Π, che può essere definita come la forza che deve essere applicata per impedire lo spostamento delle molecole di solvente attraverso una membrana semipermeabile.
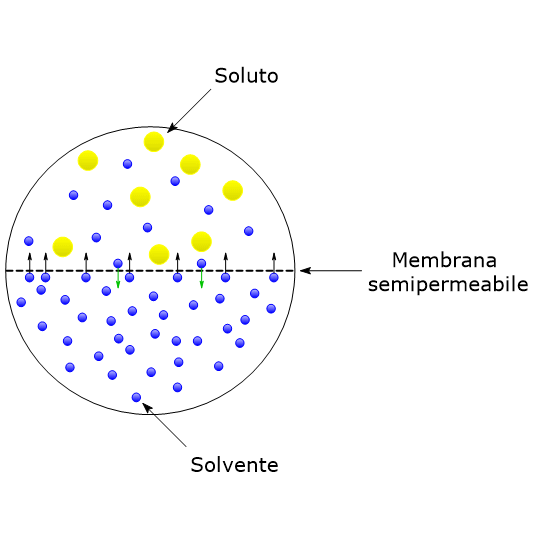
Assieme all’innalzamento del punto di ebollizione, all’abbassamento del punto di congelamento e alla tensione di vapore, la pressione osmotica è una delle quattro proprietà colligative delle soluzioni, proprietà che dipendono solo dal numero di particelle di soluto presenti in soluzione, ioni, molecole o strutture sopramolecolari che siano, e non dalla natura delle particelle stesse o dalla loro massa.
Per soluzioni con n soluti, l’equazione che descrive la pressione osmotica è la somma dei contributi di ciascun soluto:
Π = RT(i1c1 + i2c2 + … + incn)
L’equazione è conosciuta come equazione di van ‘t Hoff, dove:
- T è la temperatura assoluta, che è espressa in Kelvin;
- R è la costante dei gas, pari a 8,314 J/mole K;
- c è la concentrazione molare del soluto;
- i è il fattore di van ‘t Hoff.
Indice
- Fattore di van ‘t Hoff
- Pressione osmotica, osmosi e membrane cellulari
- Pressione osmotica, amido e glicogeno
- Diarrea osmotica
- Pressione osmotica, galattosemia e cataratta
- Bibliografia
Fattore di van ‘t Hoff
Il fattore di van ‘t Hoff è una misura del grado di dissociazione del soluto in soluzione, ed è descritto dall’equazione:
i = 1 + α(n-1)
dove:
- α è il grado di dissociazione delle molecole di soluto, pari al rapporto tra le moli delle molecole di soluto che hanno subito dissociazione e il numero delle moli iniziali, e può assumere valori compresi tra 0, per sostanze che non si ionizzano o dissociano, e 1, per sostanze che si ionizzano o dissociano completamente in soluzione;
- n è il numero di ioni ottenuti dalla dissociazione completa della molecola di soluto.
Se si considerano specie non ionizzabili, come il glucosio, il glicogeno o l’amido, n = 1 e i = 1, mentre, per specie che in soluzione diluite si dissociano completamente, come acidi e basi forti o sali, il fattore di van ‘t Hoff è un numero intero maggiore di uno, essendo α = 1 e n pari ad almeno 2. Se ad esempio si considera il cloruro di sodio, NaCl, il cloruro di potassio, KCl, o il cloruro di calcio, CaCl2, si ha:
NaCl → Na+ + Cl–
KCl → K+ + Cl–
CaCl2 → Ca2+ + 2 Cl–
Quindi nei primi due casi i = 2, mentre con il cloruro di calcio è pari a 3.
Infine, per sostanze che non si ionizzano completamente, come acidi e basi deboli, i non è un numero intero.
Il termine ic, il prodotto del fattore di van ‘t Hoff e la concentrazione molare del soluto, è l’osmolarità della soluzione, ossia la concentrazione delle particelle di soluto osmoticamente attive per litro di soluzione.
Pressione osmotica, osmosi e membrane cellulari
L’osmosi può essere definita come il movimento o flusso netto di un solvente attraverso una membrana semipermeabile, sotto la spinta delle differenze di pressione osmotica tra i due lati della membrana, al fine di cercare di uguagliare la concentrazione del soluto ai due lati della membrana stessa. Nei sistemi biologici l’acqua è il solvente e le membrane plasmatiche sono le membrane semipermeabili.
Le membrane plasmatiche consentono il passaggio alle molecole d’acqua, grazie alla presenza di canali proteici, le acquaporine, nonché a piccole molecole non polari che possono diffondere rapidamente attraverso esse, mentre sono stanzialmente impermeabili a ioni e macromolecole.
La presenza all’interno della cellula di macromolecole come acidi nucleici, proteine, glicogeno e aggregati sopramolecolari, ad esempio i complessi multienzimatici, ma anche ioni in concentrazione maggiore rispetto a quella dell’ambiente extracellulare, fa si che la pressione osmotica guidi l’acqua dall’esterno all’interno della cellula. Se questo flusso netto di acqua verso l’interno della cellula non fosse controbilanciato si avrebbe in breve una distensione della membrana plasmatica tale da comportarne la rottura, ossia la cellula scoppierebbe a causa di un eccesso di acqua al suo interno, si verificherebbe cioè una lisi osmotica. In condizioni fisiologiche questo non avviene in quanto nel corso dell’evoluzione si sono sviluppati diversi meccanismi che si oppongono, e in alcuni casi addirittura sfruttano, queste forze osmotiche.
Due di questi sono le pompe ioniche energia dipendenti e, nei batteri, nei fungi e nelle cellule vegetali, la parete cellulare.
Pompe ioniche energia dipendenti
Le pompe ioniche riducono, con spesa di ATP, le concentrazioni intracellulari di determinati ioni rispetto alle loro concentrazioni nell’ambiente extracellulare, creando quindi una ineguale distribuzione degli ioni stessi sui due lati della membrana plasmatica, ossia creando un gradiente ionico. In questo modo la cellula controbilancia le forze osmotiche dovute agli ioni e macromolecole intrappolate al suo interno. Un esempio di pompa ionica energia dipendente è la Na+/K+ ATPasi, che riduce la concentrazione intracellulare di Na+ rispetto all’esterno della cellula.
Parete cellulare
Le cellule vegetali sono circondate da una matrice extracellulare, la parete cellulare, che, essendo non espandibile e posizionata in prossimità della membrana plasmatica, permette alla cellula di resistere alle forze osmotiche che potrebbero causarne il rigonfiamento e infine la lisi. In che modo?
Nelle cellule vegetali mature i vacuoli sono gli organelli di dimensioni maggiori, arrivando a occupare circa l’80% del volume cellulare. Al loro interno vengono accumulate grandi quantità di soluti, per la maggior parte acidi organici e inorganici, i quali osmoticamente richiamano acqua, il che determina il rigonfiamento del vacuolo stesso. A sua volta questo fa si che il tonoplasto, la membrana che circonda l’organello, spinga la membrana plasmatica contro la parete cellulare, la quale, opponendosi meccanicamente a queste forze, permette di evitare la lisi osmotica. Questa pressione osmotica è chiamata pressione di turgore e può raggiungere le 20 atmosfere, 2 MPa, un valore circa 10 volte maggiore rispetto alla pressione dei pneumatici. La pressione di turgore è responsabile della rigidità delle parti non legnose delle piante, è coinvolta nella crescita della pianta, nonchè:
- nell’avvizzimento della verdura, a seguito di una sua riduzione;
- nei movimenti delle piante, quali:
- i movimenti circadiani delle foglie;
- i movimenti delle foglie della Dionaea muscipula, una pianta carnivora, o delle foglie delle Mimosa pudica.
Anche nei batteri e funghi la membrana plasmatica è circondata da una parete cellulare sufficientemente rigida e non espandibile da impedire la lisi osmotica della cellula.
Soluzioni isotoniche, ipotoniche e ipertoniche
Dal confronto tra la pressione osmotica di sue soluzioni separate da una membrana semipermeabile è possibile definire tre tipi di soluzioni, di seguito brevemente descritte.
- Due soluzioni che abbiano la stessa pressione osmotica sono definite isotoniche.
- Se due soluzioni hanno differenti pressione osmotica, quella a pressione maggiore viene definita ipertonica rispetto all’altra.
- Se due soluzioni hanno differenti pressioni osmotiche, quella a pressione minore viene definita ipotonica rispetto all’altra.
Nei sistemi biologici la soluzione di riferimento è rappresentata dal citosol; quindi, ponendo una cellula in una soluzione:
- isotonica, non si avrà trasferimento netto di acqua tra l’interno e l’esterno della cellula stessa;
- ipertonica, sia avrà un trasferimento netto di acqua dalla cellula verso l’esterno, la cellula perde acqua e si raggrinzisce;
- ipotonica, si verifica un trasferimento netto di acqua al suo interno, la cellula si rigonfia e può arrivare a scoppiare, ossia si può verificare una lisi osmotica.
In aggiunta alle pompe ioniche e alla parete cellulare, nel corso dell’evoluzione gli organismi pluricellulari hanno sviluppato un’altra soluzione per opporsi alle forze osmotiche: circondare le cellule con soluzioni isotoniche o prossime all’isotonicità che impediscano o comunque limitino un influsso o un efflusso netto di acqua. Un esempio è il plasma, ossia il sangue privato della componente cellulare, che, grazie alla presenza di sali e proteine, nell’uomo principalmente l’albumina, ha un’osmolarità simile a quella presente nel citosol.
Pressione osmotica, amido e glicogeno
Gli organismi immagazzinano glucosio non in forma libera ma come polimeri, glicogeno gli animali, i funghi e i batteri, amido le piante, in questo modo evitando che la pressione osmotica esercitata dalle riserve di carboidrati diventi troppo grande. Infatti, dato che la pressione osmotica, al pari delle altre proprietà colligative, dipende solo dal numero delle molecole di soluto, immagazzinare milioni di molecole di glucosio in forma di un numero notevolmente inferiore di polisaccaridi permette di evitarne un aumento abnorme. Di seguito alcuni esempi.
- Se si considera un polisaccaride, come il glicogeno o amido, formato da 1000 unità di glucosio e del peso di un grammo, questi ha un effetto sulla pressione osmotica inferiore a quello di un milligrammo di glucosio libero.
- Considerando un epatocita, se il glucosio immagazzinato in forma di glicogeno fosse presente come glucosio libero, la sua concentrazione sarebbe di circa 0,4 M, contro una concentrazione del glicogeno di circa 0,04 μM. Questo causerebbe un flusso netto di acqua verso l’interno della cellula tale da portare a lisi osmotica.
Inoltre, se anche si riuscisse a evitare la lisi osmotica, si avrebbero problemi riguardo al trasporto del glucosio all’interno della cellula. Nell’uomo, in condizioni fisiologiche, il sistema preposto alla regolazione della glicemia agisce in modo da mantenere i livelli glucosio nel sangue compresi tra 3,33 e 5,56 mmol/L o 60-100 mg/dL. Se il glucosio fosse immagazzinato in forma libera la sua concentrazione intracellulare sarebbe da 120 a 72 volte maggiore di quella sanguigna, e il suo trasporto nell’epatocita comporterebbe un grande dispendio energetico.
Diarrea osmotica
In presenza di malattie che causano l’accumulo di soluti non assorbiti e osmoticamente attivi nella porzione distale dell’intestino tenue e nel colon, si verifica una condizione nota come diarrea osmotica.
Tra le cause fisiopatologiche si annoverano, ad esempio, infezioni batteriche, malattie del pancreas, la celiachia, un’enteropatia autoimmune indotta dall’assunzione di glutine in soggetti geneticamente predisposti, o un deficit congenito di una delle disaccaridasi dell’orletto a spazzola degli enterociti, come nel caso dell’intolleranza al lattosio. In queste condizioni la digestione dei carboidrati può essere incompleta a causa di un deficit a carico della alfa-amilasi e/o di una o più disaccaridasi. Inoltre, i soluti osmoticamente attivi non assorbiti passano nel colon dove possono essere fermentati dai batteri del microbiota intestinale, che fa parte del microbiota umano, con conseguente eccessiva produzione di gas, come idrogeno, anidride carbonica e metano, e acidi grassi catena corta, in particolare l’acido butirrico, l’acido propionico e l’acido acetico. Ciò provoca una condizione nota come diarrea osmotico-fermentativa.
La diarrea osmotica può anche essere consente all’uso di lassativi osmotici come polietilenglicole o PEG e il solfato di magnesio.
L’accumulo di soluti osmoticamente attivi derivanti dalla digestione incompleta al pari dei lassativi osmotici portano a un aumento della pressione osmotica intraluminale e inibiscono il normale assorbimento di acqua ed elettroliti, provocando una riduzione della consistenza delle feci e un aumento della motilità intestinale.
Pressione osmotica, galattosemia e cataratta
Il galattosio, con il fruttosio e il glucosio, è uno dei tre monosaccaridi che possono essere assorbiti a livello intestinale. Metabolizzato per la maggior parte nel fegato, e in misura minore da altri organi e tessuti, previa conversione in UDP-galattosio e UDP-glucosio attraverso la via di Leloir, può essere utilizzato a scopi anabolici o catabolici. Mutazioni a carico di uno dei geni che codificano per gli enzimi della via di Leloir ne provocano l’accumulo e causano la galattosemia, una malattia metabolica congenita la cui unica cura è una dieta a ridotto contenuto di galattosio.
L’accumulo del monosaccaride determina l’attivazione di vie metaboliche alternative alla via di Leloir che portano alla sua conversione in galattitolo e galattonato.
Tra i sintomi della galattosemia si ritrova la comparsa precoce di cataratta e tra i fattori scatenanti sembra esserci la sintesi di galattitolo nella lente dell’occhio. Il galattitolo è un poliolo scarsamente metabolizzato e, data la sua scarsa lipofilicità, non diffonde attraverso la membrana plasmatica, accumulandosi nella cellula. Essendo osmoticamente attivo determina un aumento della pressione osmotica intracellulare e di conseguenza un richiamo d’acqua. L’effetto osmotico sembra essere uno dei meccanismi attraverso cui il galattitolo concorre allo sviluppo della cataratta in caso di galattosemia.
Bibliografia
- Beauzamy L., Nakayama N., and Boudaoud A. Flowers under pressure: ins and outs of turgor regulation in development. Ann Bot 2014;114(7):1517-1533. doi:10.1093/aob/mcu187
- Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5th Edition. W. H. Freeman and Company, 2002
- Coelho A.I., Berry G.T., Rubio-Gozalbo M.E. Galactose metabolism and health. Curr Opin Clin Nutr Metab Care 2015;18(4):422-427. doi:10.1097/MCO.0000000000000189
- Coelho A.I., Rubio-Gozalbo M.E., Vicente J.B., Rivera I. Sweet and sour: an update on classic galactosemia. J Inherit Metab Dis 2017;40(3):325-342. doi:10.1007/s10545-017-0029-3
- Conte F., van Buuringen N., Voermans N.C., Lefeber D.J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: time for a closer look. Biochim Biophys Acta Gen Subj 2021;1865(8):129898. doi:10.1016/j.bbagen.2021.129898
- Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010
- Heldt H-W. Plant biochemistry – 3th Edition. Elsevier Academic Press, 2005
- Michal G., Schomburg D. Biochemical pathways. An atlas of biochemistry and molecular biology. 2nd Edition. John Wiley J. & Sons, Inc. 2012
- Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012
- Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- Pintor J. Sugars, the crystalline lens and the development of cataracts. Biochem Pharmacol 2012;1:4. doi:10.4172/2167-0501.1000e119
- Tropini C., Moss E.L., Merrill B.D., Ng K.M., Higginbottom S.K., Casavant E.P., Gonzalez C.G., Fremin B., Bouley D.M., Elias J.E., Bhatt A.S., Huang K.C., Sonnenburg J.L. Transient osmotic perturbation causes long-term alteration to the gut microbiota. Cell 2018;173(7):1742-1754.e17. doi:10.1016/j.cell.2018.05.008