Un ciclo futile, o ciclo del substrato, si instaura quando due reazioni opposte, non all’equilibrio e catalizzate da enzimi differenti, o due vie metaboliche opposte avvengono simultaneamente senza altro effetto complessivo se non un dispendio di energia.[1]
Il nome di ciclo futile fu coniato in quanto all’apparenza questi cicli sembravano non portare alcun beneficio alla cellula, una sorta di imperfezione metabolica.[2]
Tuttavia, recentemente, sono stati riconosciuti come importanti per la produzione di calore, l’amplificazione dei segnali metabolici, la redistribuzione di energia, in forma di trigliceridi, tra tessuto adiposo e fegato, e per le modificazioni a carico degli acidi grassi immagazzinati nei trigliceridi del tessuto adiposo.[3][4][5]
Per evitare un dispendio incontrollato di energia, i cicli futili sono strettamente controllati.
Esempi di cicli futili sono la glicolisi e la gluconeogenesi quando procedono simultaneamente a elevata velocità nella stessa cellula, il ciclo di Cori, e il ciclo trigliceridi/acidi grassi.[6]
Indice
- Amplificazione del segnale
- Regolazione
- Glicolisi e gluconeogenesi
- Ciclo di Cori
- Ciclo trigliceridi/acidi grassi
- Generazione di calore
- Bibliografia
Amplificazione del segnale
Consideriamo una via ciclica che da A porta a B e viceversa. Supponiamo che il tasso di conversione di A in B sia 100, e quella di B in A 90. Ne risulta un flusso netto di A verso B di 10. Si immagini ora un effettore che aumenti la conversione di A in B del 30%, portandola a 130, e contemporaneamente riduca del 30% la conversione di B in A, portandola a 63. Il flusso netto risultante è pari a 130-63 = 67. Ne risulta un aumento del flusso netto pari a 570% a seguito di una variazione del 30% nella velocità delle reazioni opposte. Modifiche di questo tipo potrebbero, almeno in parte, spiegare l’aumento anche di 1000 volte del flusso di carbonio lungo la glicolisi nella fase iniziale di un esercizio intenso.[2]
Regolazione
Nel corso dell’evoluzione, la selezione di enzimi differenti per la catalisi di reazioni irreversibili e contrapposte ha permesso di evitare l’instaurarsi di cicli futili o di metterli sotto stretto controllo. In che modo? La selezione di un enzima che catalizza la conversione di A in B, e di un secondo enzima che catalizza la conversione di B in A, le cui attività sono regolate separatamente, permette il controllo della direzione netta del flusso metabolico.[7]
Il controlla delle attività enzimatiche può avvenire mediante:
- meccanismi allosterici;
- modificazioni covalenti;
- modificazioni nella concentrazione degli enzimi coinvolti, conseguenti a variazioni del rapporto tra la loro sintesi e degradazione. Un meccanismo differente regola la glucochinasi epatica (EC 2.7.1.2). Durante il digiuno, l’enzima si lega in modo reversibile alla GKPR, una delle proteine specifiche del fegato, che lo ancora all’interno del nucleo, separandolo dagli altri enzimi glicolitici, e impedendo così l’instaurarsi di un ciclo futile tra glicolisi e gluconeogenesi.
Grazie a questi meccanismi di controllo è così possibile ottenere una regolazione coordinata delle due vie contrapposte, evitando un ciclo futile incontrollato. Ovviamente, una regolazione così fine non potrebbe essere ottenuta se un singolo enzima operasse in entrambe le direzioni.[8]
Glicolisi e gluconeogenesi
Considerando la glicolisi e la gluconeogenesi, la prima via porta alla conversione del glucosio in piruvato, la base coniugata dell’acido piruvico, con produzione di ATP, mentre la seconda converte il piruvato in glucosio, con consumo di ATP. Se le due vie procedessero simultaneamente ad alta velocità nella stessa cellula si avrebbe solo un consumo netto di ATP, quindi un ciclo futile. Ciò è evitato attraverso il controllo delle tappe irreversibili dei due processi, in particolare delle reazioni catalizzate dalla fosfofruttochinasi-1 (PFK-1; EC 2.7.1.11) e dalla fruttosio-1,6-bisfosfatasi (FBPasi; EC 3.1.3.11), principalmente ad opera dall’effettore allosterico fruttosio 2,6-bifosfato.[7]
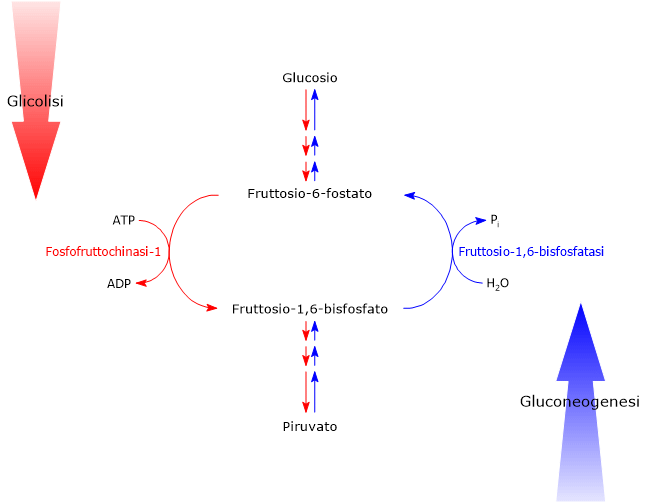
Da notare che mentre nella glicolisi il controllo allosterico coinvolge tutte e tre le reazioni irreversibili, nella gluconeogenesi i punti di regolazione cruciali sono le reazioni catalizzate dalla piruvato carbossilasi (EC 6.4.1.1) e dalla fruttosio-1,6-bisfosfatasi.[8]
Ciclo di Cori
Con il ciclo di Cori una parte dell’acido lattico prodotto dal muscolo e da altri tessuti extraepatici raggiunge il fegato, dove è convertito in glucosio che, rilasciato in circolo, torna al muscolo e ad altri tessuti extraepatici chiudendo il ciclo. Dal punto di vista energetico il ciclo di Cori può essere considerato un ciclo futile perché per ogni ciclo si ha come unico effetto apparente un consumo netto di 4 ATP, come per il ciclo glicolisi/gluconeogenesi. Tuttavia, questo ciclo permette il funzionamento di molti differenti tipi di cellule extraepatiche a spese del fegato.[6]
Ciclo trigliceridi/acidi grassi
Nel ciclo trigliceridi/acidi grassi, i trigliceridi nel tessuto adiposo vengono parzialmente o completamente idrolizzati in acidi grassi liberi e glicerolo, in un processo chiamato lipolisi; quindi, gli acidi grassi rilasciati vengono utilizzati per sintetizzare nuove molecole di trigliceridi.[3][6][7] Per ogni mole di trigliceridi che completa il ciclo vengono consumate 4 moli di ATP.
Questo ciclo futile può avvenire:
- tra il tessuto adiposo, che rilascia acidi grassi, e il fegato, che li riesterifica in trigliceridi, portando a una ridistribuzione dell’energia immagazzinata;[4]
- negli adipociti, dove può contribuire alla termogenesi e alla modifica degli acidi grassi immagazzinati.
Per quanto riguarda le modifiche degli acidi grassi immagazzinati, il ciclo li rende accessibili a reazioni di allungamento e desaturazione, che consentono la conversione degli acidi grassi saturi in acidi grassi insaturi. Tuttavia, sembra che l’efficienza del processo dipenda dal tipo di acidi grassi. Ad esempio, il metabolismo degli acidi grassi a catena media è più rapido della conversione dell’acido palmitico, uno degli acidi grassi a catena lunga, negli acidi palmitoleico e oleico, e poi, negli epatociti, in acido arachidonico. Si noti che la conversione degli acidi grassi a catena media e dell’acido palmitico in acidi grassi insaturi a catena lunga riduce il rischio per la salute associato al loro accumulo nei trigliceridi immagazzinati.[5]
Generazione di calore
In alcuni casi un ciclo futile ha la sola funzione di produrre calore a mezzo dell’idrolisi di ATP.
Questo si verifica ad esempio nei muscoli alari dei bombi, i quali, per volare devono mantenere una temperatura toracica di circa 30 °C, anche quando la temperatura esterna è bassa, fino anche a 10 °C. La temperatura toracica è mantenuta ai livelli ottimali per consentire il volo grazie al ciclo futile che si instaura tra le reazioni catalizzate dagli enzimi PFK-1 e FBPasi. Infatti, la FBAasi dei muscoli alari non è inibita dall’AMP, il che sembra suggerire che nel corso dell’evoluzione questa proteina sia stata selezionata appositamente per la produzione di calore.
Al contrario dei bombi, nei muscoli alari delle api mellifere non è quasi presente la FBPasi, e pertanto questi insetti non possono volare quando la temperatura esterna è bassa.[2]
Bibliografia
- ^ Newsholme E.A. Substrate cycles: their metabolic, energetic and thermic consequences in man. Biochem Soc Symp. 1978;43:183–205.
- ^ a b c Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5th Edition. W. H. Freeman and Company, 2002
- ^ a b Reshef L., Olswang Y., Cassuto H., Blum B., Croniger C.M., Kalhan S.C., Tilghman S.M., Hanson R.W. Glyceroneogenesis and the triglyceride/fatty acid cycle. J Biol Chem 2003;278(33):30413-6. doi:10.1074/jbc.R300017200
- ^ a b Sharma A.K., Wolfrum C. Lipid cycling isn’t all futile. Nat Metab 2023;5(4):540-541. doi:10.1038/s42255-023-00779-x
- ^ a b Wunderling K., Zurkovic J., Zink F., Kuerschner L., Thiele C. Triglyceride cycling enables modification of stored fatty acids. Nat Metab 2023;5(4):699-709. doi:10.1038/s42255-023-00769-z
- ^ a b c Brownstein A.J., Veliova M., Acin-Perez R., Liesa M., Shirihai O.S. ATP-consuming futile cycles as energy dissipating mechanisms to counteract obesity. Rev Endocr Metab Disord 2022;23(1):121-131. doi:10.1007/s11154-021-09690-w
- ^ a b c Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- ^ a b Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010