I carotenoidi sono una classe di pigmenti liposolubili ampiamente presenti in natura.
Sono composti organici di colore giallo, arancio e rosso, sono costituiti da 8 unità isopreniche e hanno numerosi doppi legami coniugati. La loro catena idrocarburica può andare incontro a modificazioni che ne influenzano significativamente le proprietà biologiche.
Scoperti nella prima metà del 1800, i carotenoidi sono prodotti da tutti gli organismi fotosintetici, comprese piante, macroalghe e microalghe. Inoltre sono sintetizzati anche da organismi non fotosintetici quali alcuni tipi di funghi, batteri e insetti come gli Afidi dei piselli, il ragnetto rosso, una specie di acaro, e alcune specie di moscerini.
Con polifenoli e glucosinolati, costituiscono il gruppo dei fitochimici.
Nel corso dell’evoluzione, grazie alle loro proprietà chimiche e fisiche, si sono dimostrati estremamente versatili, essendo in grado di svolgere molte funzioni sia nelle piante che negli animali, tra le quale è molto importante l’azione antiossidante. Inoltre, nell’uomo molti carotenoidi sono precursori della vitamina A.
Si contano più di 750 carotenoidi differenti, più di 100 sono stati trovati nella frutta e verdura, e circa 40 sono assunti in quantità significative dall’uomo.
Grazie al loro colore, i carotenoidi sono utilizzati come additivi alimentari.
Indice
- La scoperta
- Struttura chimica
- Isomeria
- Classificazione
- Solubilità
- Colore
- Ruolo nelle piante
- Fonti alimentari
- Additivi alimentari
- Carotenoidi e salute dell’uomo
- Carotenoidi nel plasma
- Bibliografia
La scoperta
I carotenoidi sono stati scoperti nella prima metà del diciannovesimo secolo.
Il primo carotenoide a essere isolato fu il beta-carotene nel 1831, grazie al lavoro del farmacista tedesco Heinrich Wilhelm Ferdinand Wackenroder, il quale chiamò carotene il pigmento giallo che riuscì a cristallizzare dalla radice della carota.
Jöns Jacob Berzelius, considerato uno dei padri della chimica moderna, chiamò xantofille, dal greco xanthos, che significa giallo, e phyllon che significa foglia, i pigmenti gialli estratti dalle foglie autunnali.
Mikhail Semyonovich Tsvet , botanico italo-russo, che nel 1906 ideò la cromatografia, riuscì a separare i pigmenti fogliari, ossia le clorofille dai caroteni e xantofille, grazie alla cromatografia su colonna, e chiamò carotenoidi i pigmenti dal giallo all’arancio.
Struttura chimica
I carotenoidi sono una classe di lipidi aventi come unità strutturale di base una sequenza lineare di otto unità isopreniche. Sono quindi terpeni, precisamente tetraterpeni, per un totale di 40 atomi di carbonio.
Le unità isopreniche sono unite con un relazione posizionale 1,5, ossia testa-coda, tranne al centro della catena idrocarburica, dove la relazione posizionale è 1,6, quindi coda-coda, il che, invertendo l’ordine, rende la molecola simmetrica.
I carotenoidi sono caratterizzati dalla presenza di un esteso sistema di doppi legami, dei quali da 3 a 13 possono essere coniugati.
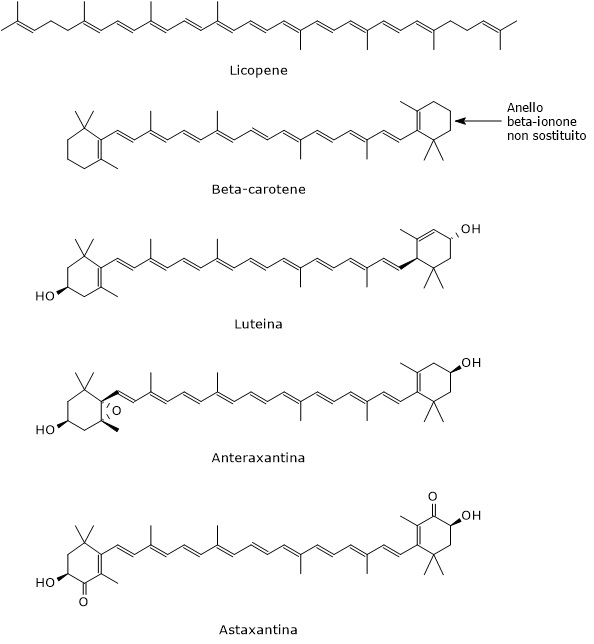
La catena idrocarburica dei carotenoidi può andare incontro a modificazioni chimiche quali idrogenazione, deidrogenazione, introduzione di atomi di ossigeno, ciclizzazione di una o entrambe le estremità a formare anelli ionone, ed esterificazione con acidi grassi. Tali modificazioni permettono la formazione di molte strutture differenti, la maggior parte delle quali sono descritte dalla formula chimica C40H56On, con 0≤n≤6.
Tradizionalmente, ai carotenoidi sono stati assegnati nomi comuni provenienti dalla fonte biologica da cui sono stati isolati, sebbene possano essere denominati anche utilizzando la nomenclatura IUPAC.
Isomeria
I carotenoidi presentano molti doppi legami che possono avere isomeria cis–trans, anche detta isomeria geometrica. Sebbene ognuno dei doppi legami possa essere in configurazione cis o trans, in natura la configurazione prevalente è la trans, termodinamicamente più stabile rispetto alla configurazione cis grazie al minor ingombro sterico tra i sostituenti.
La rotazione intorno ai legami semplici, o legami sigma, presenti lungo la catena carboniosa permette anche la formazione di isomeri conformazionali. Quando i doppi legami sono presenti sullo stesso lato rispetto al legame sigma si parla di conformazione s-cis. Al contrario, se i doppi legami sono su lati opposti rispetto al legame sigma si parla di conformazione s-trans.
In natura i carotenoidi aciclici sono principalmente in conformazione s-trans, in quanto è quella a minor ingombro sterico. In presenza di strutture cicliche alle estremità della catena del carotenoide, la rotazione intorno al legame sigma C6-C7 da luogo alla formazione di un isomero 6-s-cis a minor ingombro sterico e quindi energeticamente favorito.
Si noti che l’ingombro sterico e le dimensioni dei carotenoidi influenzano la capacità di interagire con enzimi o di formare strutture sovramolecolari.
La maggior parte dei carotenoidi presenta anche un centro di chiralità o un asse di chiralità, che fa si che esistano isomeri ottici. In questi casi, per dare un nome univoco alla molecola si ricorre al sistema RS, e non alle regole della convenzione di Fischer, utilizzata solo per carboidrati e aminoacidi.
Classificazione
I carotenoidi possono essere classificati sulla base della presenza o meno di ossigeno o di strutture cicliche.
Sulla base della presenza o meno di ossigeno sono suddivisi in xantofille e caroteni.
I caroteni, privi di ossigeno, sono formati da soli atomi di carbonio e idrogeno, e hanno formula chimica C40H56. Esempi di caroteni sono l’alfa-carotene, il beta-carotene, il delta-carotene, lo zeta-carotene, il fitoene, e il licopene.
Le xantofille contengono anche atomi di ossigeno, hanno formula chimica C40H56On, con 0˂n≤6, e possono a loro volta essere suddivise in:
- idrossicarotenoidi, che contengono almeno un gruppo idrossilico, come l’alfa-criptoxantina, la beta-criptoxantina, la zeaxantina e la luteina;
- epossicarotenoidi, che presentano almeno un gruppo epossidico, come l’anteraxantina, l’auroxantina e la luteoxantina;
- chetocarotenoidi, che presentano uno o più gruppi carbonilici, come l’astaxantina e la cantaxantina.
La presenza o meno di strutture cicliche nella molecola permette la suddivisione in carotenoidi ciclici e aciclici.
- I carotenoidi ciclici contengono una o due strutture cicliche, e, rispetto agli aciclici sono più corti, ma con un ingombro sterico maggiore e un maggior spazio occupato. Esempi sono l’alfa-carotene, il beta-carotene, il gamma-carotene e il delta-carotene.
- I carotenoidi aciclici sono molecole formate da una catena carboniosa lineare. Esempi sono il licopene, lo zeta-carotene, il fitoene, e il fitofluene.
Infine esistono anche carotenoidi non comuni o specie-specifici, come la bixina, la capsantina e la capsorubina.
Solubilità
I carotenoidi sono molecole idrofobiche, quindi solubili in solventi organici, solubilità che varia in funzione dei sostituenti presenti. Data lo loro idrofobicità, nelle cellule si ritrovano nelle membrane cellulari. Nella maggior parte dei casi le xantofille presentano i gruppi polari ai lati opposti della catena, e, quando presenti nelle membrane cellulari, al fine di minimizzare l’energia del sistema, si dispongono in modo tale che i gruppi polari siano in contato con i gruppi polari del doppi strato lipidico.
I carotenoidi possono avere accesso anche all’ambiente acquoso se in associazione a proteine, cui si legano in modo non covalente. Nel plasma sono trasportati dalle lipoproteine.
Colore
Il sistema di doppi legami coniugati, agendo come un cromoforo, è responsabile del colore dei carotenoidi. Tuttavia, perché il colore sia percettibile, devono essere presenti almeno sette doppi legami coniugati, per cui molecole come il fitofluene, che ha cinque legami coniugati, o il fitoene, che ha tre doppi legami coniugati, sono incolori.
All’aumentare del numero dei doppi legami coniugati il colore vira dal giallo, all’arancio, fino al rosso; ad esempio, la luteina, l’alfa-criptoxantina e la violaxantina sono gialle, l’alfa-carotene, il beta-carotene, e il gamma-carotene sono arancio, e il licopene è rosso.
Ruolo nelle piante
Nelle piante i carotenoidi svolgono molte funzioni.
Contribuiscono alla protezione della cellula nei confronti del danno ossidativo, aumentano l’assorbimento della luce solare, sono i precursori di fitormoni, come l’acido abscissico, e intervengono nelle vie di segnalazione.
Concorrono inoltre, con la clorofilla e gli antociani, una classe di flavonoidi, che sono il principale tipo di polifenoli, a determinare il colore delle foglie, dei frutti, delle verdure, dei cereali, colorazione che ha la funzione di attirare gli animali così da promuovere l’impollinazione e la dispersione dei semi.
Possono infine fungere anche da agenti repellenti per fitofagi e patogeni.
Quenching dell’ossigeno singoletto
Negli organismi che svolgono la fotosintesi ossigenica i carotenoidi concorrono alla protezione dei danni conseguenti all’eccessiva irradiazione solare.
Quando la luce che arriva complesso antenna del fotosistema II eccede la capacità di conversione dei centri di reazione, il surplus energetico può far si che la clorofilla permanga nel suo stato eccitato, il che può portare alla formazione del suo stato di tripletto. L’energia in eccesso può essere ceduta dalla clorofilla all’ossigeno molecolare determinando la formazione dell’ossigeno singoletto, una delle specie reattive dell’ossigeno, che è in grado di danneggiare l’apparato fotosintetico stesso e, più in generale, gli acidi nucleici, le proteine, gli acidi grassi insaturi di membrana, nonché i cofattori enzimatici.
I carotenoidi possono prevenire il danno ossidativo causato dall’ossigeno singoletto in due modi.
- Possono reagire direttamente con l’ossigeno singoletto, un processo noto come quenching dell’ossigeno singoletto. In questo caso l’energia viene trasferita al carotenoide dall’ossigeno singoletto, che torna allo stato fondamentale di tripletto, mentre il carotenoide passa allo stato di tripletto, dissipando poi l’energia in eccesso in forma di calore. La capacità di disattivazione dell’ossigeno singoletto aumenta all’aumentare del numero dei doppi legami coniugati, divenendo massima da nove o più doppi legami coniugati.
Studi in vitro sembrano indicare che i carotenoidi monociclici siano in grado di disattivare l’ossigeno singoletto con maggiore efficienza rispetto alle strutture acicliche, e che la presenza di gruppi carbonilici, come nell’astaxantina, aumenti il potenziale antiossidante del carotenoide rispetto a quelli con gruppi idrossilici, probabilmente grazie al più esteso sistema di doppi legami coniugati. Sembra che ogni carotenoide, prima di incorrere in reazioni di degradazione, sia in grado di interagire e disattivare circa 1000 molecole di ossigeno singoletto. - I carotenoidi sono anche in grado di prevenire la formazione dell’ossigeno singoletto assorbendo l’energia della clorofilla eccitata, passando a loro volta in uno stato di tripletto. Essendo il loro livello energetico inferiore a quello dell’ossigeno singoletto, una volta formatisi decadono spontaneamente allo stato fondamentale.
Scavenging dei radicali liberi
I carotenoidi sono in grado di agire da scavenger dei radicali liberi, quali il radicale idrossilico, i radicali perossidici, il radicale superossido, o il radicale dell’ossido nitrico. La loro azione può avvenire secondo quattro modalità differenti.
- Può verificarsi il trasferimento di un elettrone dal carotenoide al catione radicale, a formare il catione radicale del carotenoide, mentre il radicale diventa una specie neutra. Il catione del radicale carotenoide può essere rigenerato nel carotenoide di partenza grazie all’azione di altri antiossidanti cellulari come la vitamina E, la vitamina C e il glutatione.
- Si può avere il trasferimento di un protone dal carotenoide al radicale, che diventa una specie neutra, mentre il carotenoide diviene un radicale anione.
- La neutralizzazione del radicale può avvenire a seguito di reazioni di addizione, come nel caso della neutralizzazione dei radicali idrossilici e perossidici.
- Un atomo di idrogeno può essere trasferito dal carotenoide al radicale, con formazione di un radicale carotenoide stabilizzato per risonanza.
Ruolo fotoassorbente
I carotenoidi sono presenti nei complessi antenna in qualità di pigmenti fotoassorbenti accessori, principalmente associati alle proteine antenna.
Grazie al sistema di doppi legami coniugati sono in grado di assorbire la luce solare nell’intervallo 400-500 nm. L’energia assorbita viene quindi convogliata ai centri di reazione.
Gli spettri di assorbimento dei singoli carotenoidi sono determinati dalla lunghezza della coniugazione e dal tipo di gruppi funzionali presenti.
Il principale carotene coinvolto nell’assorbimento della radiazione solare è il beta-carotene, presente nel nucleo del fotosistema I e II di tutti gli organismi che operano una fotosintesi ossigenica, mentre la luteina, la violaxantina, la neoxantina e la zeaxantina, le principali xantofille nelle piante, sono legate ai complessi di raccolta della luce.
Fonti alimentari
Gli esseri umani non sono in grado di sintetizzare i carotenoidi, li assumono dagli alimenti, li accumulano principalmente nel fegato e nel tessuto adiposo, ma anche nei polmoni, nei reni, nel cervello e nelle ossa, dove svolgono molte funzioni.
Di tutti i carotenoidi attualmente identificati, un centinaio sono presenti negli alimenti consumati dall’uomo, mentre, se si considera il singolo alimento, in genere ne sono presenti da uno a cinque principali, accompagnati da altri presenti in tracce o comunque piccole quantità.
Frutta e verdura sono la principale fonte di carotenoidi nella dieta umana. Tra le verdure, quelle a foglia verde sono ricche di beta-carotene, il carotenoide più abbondante nella dieta e nei tessuti umani, e luteina, seguiti da violaxantina e neoxantina, la radice delle carote è ricca di beta-carotene, la zucca di alfa-carotene, il pomodoro di licopene, e i peperoni di capsantina e capsorubina. I carotenoidi della frutta sono molto vari, e quelli dei frutti maturi possono essere diversi da quelli dei frutti acerbi. Inoltre, la maggior parte dei carotenoidi presenti nei frutti maturi sono esterificati con acidi grassi. Tuttavia, quelli di alcuni frutti, in particolare dei frutti che a maturazione terminata rimangono verdi, come il kiwi, subiscono una limitata o assente esterificazione.
Le uova di gallina, grazie al fatto che le galline ovaiole mangiano per la maggior parte il mais, possono essere una buona fonte di alcuni carotenoidi, come la luteina e zeaxantina, responsabili del colore giallo-arancio del tuorlo.
Infine, molluschi e crostacei, che con i pesci sono le fonti per eccellenza di acidi grassi polinsaturi omega-3 a catena lunga, quali l’acido eicosapentaenoico e l’acido docosaesaenoico, sono anche la principale fonte dei carotenoidi prodotti dalle microalghe e che raramente si trovano nelle piante, quali l’astaxantina presente nei gamberetti, ma anche nel salmone.
Additivi alimentari
I carotenoidi aggiunti ai cibi come additivi alimentari, a differenza dei carotenoidi naturalmente presenti, sono relativamente instabili, essendo suscettibili all’azione dell’ossigeno e della luce solare, all’auto-ossidazione, e alla dispersione nell’alimento, che ne facilita la degradazione. Inoltre, alla temperatura corporea e a quella di conservazione degli alimenti i carotenoidi aggiunti sono presenti in forma cristallina a causa del loro elevato punto di fusione; per ovviare a questo problema sono utilizzati in forma di emulsione olio in acqua.
Grazie al loro potere colorante sono utilizzati come coloranti in prodotti che, a causa della lavorazione o della conservazione tendono a perdere parte del loro colore naturale, o per uniformare il colore del prodotto, come nel caso delle bevande, dei succhi di frutta o degli insaccati, o per intensificarne il colore, migliorandone quindi l’aspetto.
Essendo precursori di composti responsabili del sapore e aroma di alcuni alimenti, possono essere utilizzati come esaltatori di sapidità.
Poiché alcuni carotenoidi sono precursori della vitamina A, sono utilizzati per fortificare gli alimenti.
Va infine sottolineato che, quando aggiunti agli alimenti, i carotenoidi non sono dei potenti antiossidanti.
Carotenoidi e salute dell’uomo
Nell’uomo i carotenoidi svolgono importanti funzioni.
Il ruolo più importante è quello di precursori della vitamina A, che da sola controlla l’espressione di quasi 700 geni. Non tutti i carotenoidi ne sono precursori; solo quelli che posseggono l’anello beta-ionone non sostituito possono essere convertiti nella vitamina, conversione che avviene a livello intestinale o nei tessuti di destinazione. Il più importante è il beta-carotene, che è la provitamina A per eccellenza e, avendo due anelli beta-ionone non sostituiti, viene convertito in due molecole di vitamina A. L’alfa-carotene e la beta-criptoxantina, avendo un solo anello beta-ionone non sostituito, possono dare una sola molecola di vitamina A, quindi hanno il 50% di attività di provitamina A.
L’importanza dell’attività di provitamina A svolta da alcuni carotenoidi è sottolineata dal fatto che la deficienza della vitamina può portare a cecità notturna e xeroftalmia, rallentare la crescita e la rigenerazione delle mucose, aumentare il tasso di mortalità causato dalle malattie infettive a seguito di disfunzioni della risposta immunitaria, ed è la singola causa più importante di cecità infantile nei paesi in via di sviluppo.
I carotenoidi contribuiscono alla salute dell’uomo anche concorrendo alla prevenzione di numerose patologie croniche attraverso meccanismi differenti rispetto all’azione di provitamina A, come l’azione antiossidante, antinfiammatoria e di fotoprotezione. Di seguito alcuni esempi.
- E’ stato osservato che una supplementazione con luteina e zeaxantina, due xantofille che si accumulano nella macula lutea, è associata a un miglioramento della funzione visiva e a una riduzione del rischio di progressione della degenerazione maculare in tarda età.
- Luteina e zeaxantina sembrano avere anche un effetto preventivo sullo sviluppo della cataratta e di retinopatie, e la luteina anche un effetto positivo sulle funzioni cognitive.
- Tra i caroteni, il consumo di cibi ricchi di licopene è stato associato a una riduzione dell’incidenza di certi tipi di tumore, come il tumore della prostata e dello stomaco, e a una riduzione del rischio cardiovascolare.
Carotenoidi nel plasma
Alfa-carotene, beta-carotene, licopene, luteina, beta-criptoxantina e zeaxantina costituiscono oltre il 90% dei carotenoidi presenti nel plasma.
Le concentrazioni plasmatiche dei carotenoidi dipendono da diversi fattori tra cui i metodi di cottura dei cibi, la quantità di lipidi nella dieta, variabili individuali riguardanti i processi di digestione dei lipidi e assorbimento dei lipidi medesimi, con i sali biliari a svolgere un ruolo essenziale, e i livelli di vitamina A nell’organismo. Considerando quest’ultimo fattore, un soggetto che abbia bassi livelli di vitamina A avrà probabilmente tassi di conversione dei carotenoidi precursori della vitamina A più elevati, e ciò potrebbe riflettersi in una minore concentrazione plasmatica.
Bibliografia
- Amengual J. Bioactive properties of carotenoids in human health. Nutrients 2019;11(10):2388. doi:10.3390/nu11102388
- Archetti, M., Döring T.F., Hagen S.B., Hughes N.M., Leather S.R., Lee D.W., Lev-Yadun S., Manetas Y., Ougham H.J. Unravelling the evolution of autumn colours: an interdisciplinary approach. Trends Ecol Evol 2009;24(3):166-73. doi:10.1016/j.tree.2008.10.006
- Böhm V., Lietz G., Olmedilla-Alonso B., Phelan D., Reboul E., Bánati D., Borel P., Corte-Real J., de Lera A.R., Desmarchelier C., Dulinska-Litewka J., Landrier J.F., Milisav I., Nolan J., Porrini M., Riso P., Roob J.M., Valanou E., Wawrzyniak A., Winklhofer-Roob B.M., Rühl R., Bohn T. From carotenoid intake to carotenoid blood and tissue concentrations – implications for dietary intake recommendations. Nutr Rev 2021;79(5):544-573. doi:10.1093/nutrit/nuaa008
- Burrows T.L., Williams R., Rollo M., Wood L., Garg M.L., Jensen M., Clare Collins C.E. Plasma carotenoid levels as biomarkers of dietary carotenoid consumption: a systematic review of the validation studies. J Nutr Intermed Metab 2015;2(1-2):15-64. doi:10.1016/j.jnim.2015.05.001
- de la Rosa L.A., Alvarez-Parrilla E., Gonzàlez-Aguilar G.A. Fruit and vegetable phytochemicals: chemistry, nutritional value, and stability. 1th Edition. Wiley J. & Sons, 2010
- Desmarchelier C., Borel P. Overview of carotenoid bioavailability determinants: from dietary factors to host genetic variations. Trends Food Sci Technol 2017;69:270-280 doi:10.1016/j.tifs.2017.03.002
- Eggersdorfer M., Wyss A. Carotenoids in human nutrition and health. Arch Biochem Biophys 2018;652:18-26. doi:10.1016/j.abb.2018.06.001
- Gruszecki W.I., Strzałka K. Carotenoids as modulators of lipid membrane physical properties. Biochim Biophys Acta 2005;1740(2):108-15. doi:10.1016/j.bbadis.2004.11.015
- Leyva-Porras C., Román-Aguirre M., Cruz-Alcantar, P., Pérez-Urizar, J.T., Saavedra-Leos M.Z. Application of antioxidants as an alternative improving of shelf life in foods. Polysaccharides 2021;2:594-607. doi:10.3390/polysaccharides2030036
- Namitha K.K., Negi P.S. Chemistry and biotechnology of carotenoids. Crit Rev Food Sci 2010;50:728-760. doi:10.1080/10408398.2010.499811
- Ramel F., Birtic S., Cuiné S., Triantaphylidès C., Ravanat J.L., Havaux M. Chemical quenching of singlet oxygen by carotenoids in plants. Plant Physiol 2012;158(3):1267-78. doi:10.1104/pp.111.182394
- Rodriguez-Amaya D.B. Food carotenoids: chemistry, biology and technology. Wiley J. & Sons, 2015.
- Saini R.K., Prasad P., Lokesh V., Shang X., Shin J., Keum Y.S., Lee J.H. Carotenoids: dietary sources, extraction, encapsulation, bioavailability, and health benefits – A review of recent advancements. Antioxidants 2022;11(4):795. doi:10.3390/antiox11040795
- Sourkes T. L. The discovery and early history of carotene. Bull Hist Chem 2009;34(1)
- Swapnil P., Meena M., Kumar Singh S., Praveen Dhuldhaj U., Harish, Marwal A. Vital roles of carotenoids in plants and humans to deteriorate stress with its structure, biosynthesis, metabolic engineering and functional aspects. Curr Plant Biol 2021;26: 100203. doi:10.1016/j.cpb.2021.100203
- Xu P., Chukhutsina V.U, Nawrocki W.J., Schansker G, Bielczynski L.W., Lu Y., Karcher D., Bock R., Croce R. Photosynthesis without β-carotene. eLife 2020;9:e58984. doi:10.7554/eLife.58984