Gli acidi grassi polinsaturi omega-3 sono acidi grassi insaturi, dunque lipidi, che presentano un doppio legame in posizione 3 rispetto all’estremità metilica, detta anche estremità n, della catena carboniosa.[3]
Per gli esseri umani gli omega-3 più importanti sono:
- l’acido alfa-linolenico o ALA o 18:3n-3, il più semplice, con 18 atomi di carbonio e tre doppi legami;
- l’acido eicosapentaenoico o EPA o 20:5n-3, con 20 atomi di carbonio e 5 doppi legami;
- l’acido docosaesaenoico o DHA o 22:6n-3, che con i suoi 22 atomi di carbonio e 6 doppi legami è il più complesso.
EPA e DHA sono definiti acidi grassi polinsaturi a catena lunga o LC-PUFA.
A causa della mancanza di due specifiche desaturasi, la delta-12 desaturasi (EC 1.14.19.6) e la delta-15 desaturasi (EC 1.14.19.13), che inseriscono doppi legami rispettivamente in posizione 6 e 3 dall’estremità metilica della catena carboniosa, i mammiferi non sono in grado di produrre l’acido linoleico o LA, capostipite della famiglia degli acidi grassi polinsaturi omega-6, e l’acido alfa-linolenico, a sua volta capostipite degli omega-3 e che deriva dall’acido linoleico.[9] L’acido linoleico e l’acido alfa-linolenico risultano pertanto essere acidi grassi essenziali.[34]
Molti animali, compreso l’uomo, hanno il corredo enzimatico necessario per sintetizzare, a partire dall’acido alfa-linolenico di origine alimentare, tutti gli altri omega-3, che quindi risultano essenziali solamente in assenza di ALA di origine alimentare, e per questo sono definiti acidi grassi semiessenziali.[9]
EPA e DHA sono componenti strutturali delle membrane cellulari che rappresentano la loro principale sede di deposito, in particolare nei tessuti muscolare e nervoso.[35] In ciò si differenziano dalla maggior parte degli altri acidi grassi che sono immagazzinati principalmente nei trigliceridi del tessuto adiposo.
Il DHA è il principale componente dei fosfolipidi delle membrane cellulari dei tessuti nervosi dei vertebrati, compresi i fotorecettori della retina, dove svolge importanti funzioni.[22][26][29][32] Oltre alla funzione strutturale, gli LC-PUFA omega-3 sono substrati per la produzione di mediatori lipidici bioattivi ad azione antiinfiammatoria quali eicosanoidi, maresine, resolvine, e protectine.[10][21]
Gli acidi grassi polinsaturi omega-3 sono essenziali nel corso dello sviluppo neurologico del feto, e la loro assunzione da parte della gestante è particolarmente importante nel terzo trimestre di gravidanza, fase in cui si verifica una crescita cerebrale significativa.[8] Nel corso della vita la loro assunzione è stata associata a una riduzione del rischio di sviluppare molte malattie croniche, in particolare le malattie cardiovascolari.[1][27][33]
Le fonti migliori per l’uomo sono i prodotti della pesca, specialmente quelli ottenuti da mari freddi.[3][9][36]
Indice
- Biosintesi
- Gli altri animali hanno bisogno di EPA e DHA?
- Benefici
- Rapporto omega-3/omega-6
- Effetti a livello molecolare di EPA e DHA
- Fonti più importanti di EPA e DHA per l’uomo
- Omega-3 negli alimenti
- Bibliografia
Biosintesi
L’acido alfa-linolenico è prodotto dall’acido linoleico, un omega-6, nei plastidi del fitoplancton e delle piante terrestri vascolari, dove è presente la delta-15 desaturasi che inserisce un doppio legame tra gli atomi di carbonio 3 e 4, numerati a partire dall’estremità metilica, di LA.[3][9]
ALA va di seguito incontro a successive reazioni di desaturazione, catalizzate dalla delta-5 desaturasi (EC 1.14.19.44) e dalla delta-6 desaturasi (EC 1.14.19.3), e di allungamento, catalizzate dalla elongasi 5 (EC 2.3.1.199) e dalla elongasi 5 e/o dalla elongasi 2 (EC 2.3.1.199), e a una limitata beta-ossidazione nei perossisomi, a dare infine DHA.[6][8]
Va sottolineato che le piante terrestri vascolari non hanno la capacità di sintetizzare LC-PUFA omega-3, come EPA e DHA.[23]
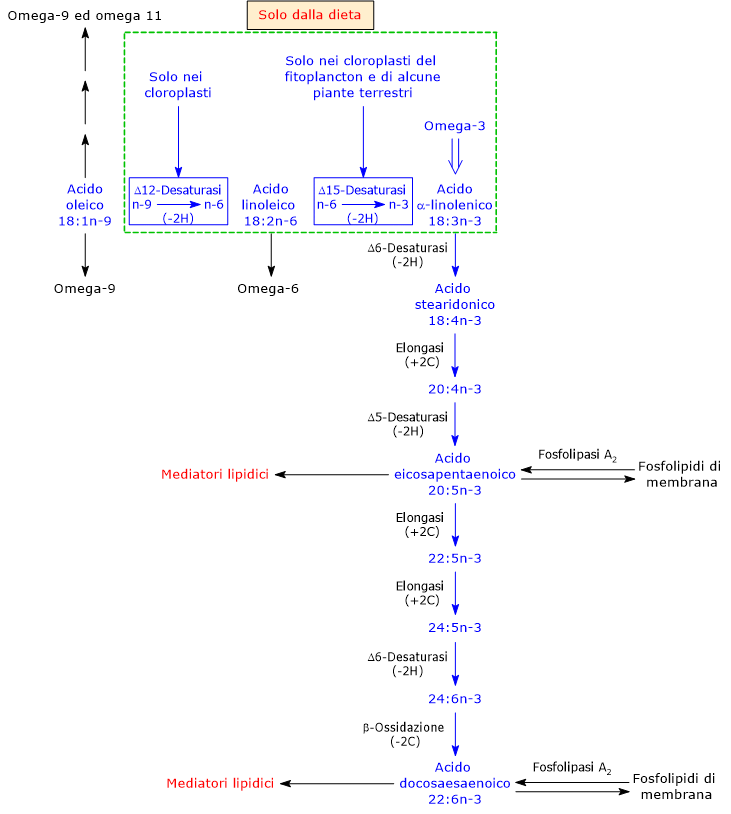
Gli enzimi che catalizzano la conversione dell’acido alfa-linolenico in DHA sono condivisi con le vie che portano alla sintesi degli acidi grassi polinsaturi omega-6, omega-7 e omega-9.[9]
Sembra che la delta-5 desaturasi e dalla delta-6 desaturasi abbiano come substrati preferenziali gli omega-3. Tuttavia, considerando che nella dieta occidentale il rapporto tra l’assunzione di ALA e LA è molto spostato a favore del secondo, ne risulterebbe favorita la via degli omega-6 rispetto alle altre.[38] Questa potrebbe essere una delle spiegazioni che giustificano il basso tasso di conversione dell’acido alfa-linolenico negli altri omega-3, sebbene anche la sintesi di acido arachidonico o ARA dall’acido linoleico sembra essere molto contenuta.
Da notare che sia la famiglia degli acidi grassi polinsaturi omega-3 che quella degli omega-6 inibiscono la formazione degli acidi grassi polinsaturi omega-9.
Biosintesi degli omega-3 nell’uomo
L’uomo, così come molti altri animali, è in grado di allungare e desaturare l’acido alfa-linolenico sino a formare il DHA, via metabolica presente principalmente nel fegato e nel microcircolo cerebrale della barriera ematoencefalica, ma anche nell’endotelio celebrale e negli astrociti.[18] E’ tuttavia opinione comune che, al pari degli altri animali terrestri, abbia una limitata capacità di produrre gli LC-PUFA, e dunque necessiti di EPA e DHA di origine alimentare.[7]
E’ stato evidenziato che l’efficienza della sintesi diminuisce lungo la via: la conversione dell’acido alfa-linolenico a EPA è limitata, e il fattore limitante sarebbe l’attività della delta-6 desaturasi. La sintesi del acido docosaesaenoico sarebbe ancora più limitata della precedente.[7] Tuttavia recenti studi hanno dimostrato l’esistenza di un marcato polimorfismo globale nel cluster dei geni FADS, i geni che codificano per le desaturasi, in particolare per quelli che codificano per la delta-5 desaturasi e delta-6 desaturasi, rispettivamente FADS1 e FADS2, geni contigui presenti sul cromosoma 11q12.2.[6]
Dal confronto tra materiale genetico di soggetti vissuti nell’Età del Bronzo con quello di popolazioni contemporanee è stato possibile ottenere un quadro chiaro riguardo ai cambiamenti della frequenza allelica nel cluster dei geni FADS.[25]
Differenze genotipiche che si sono riflesse in differenze fenotipiche.
- Nelle popolazioni europee, il passaggio da una società di cacciatori-raccoglitori a una di agricoltori avrebbe determinato un aumento dell’assunzione di acido linoleico e acido alfa-linolenico e una riduzione dell’assunzione di EPA e ARA. La selezione avrebbe quindi favorito l’aplotipo associato all’aumento dell’espressione di FADS1 e alla diminuzione dell’espressione di FADS2.[6]
- Questo è esattamente il pattern opposto a quello osservato negli Inuit, dove si ipotizza che la selezione abbia agito per favorire alleli che riducano la conversione dell’acido linoleico e dell’acido alfa-linolenico in LC-PUFA al fine di compensare il loro apporto relativamente alto con la dieta osservato in queste popolazioni.[13]
Gli altri animali hanno bisogno di EPA e DHA?
Gli organismi privi della delta-15 desaturasi non sono in grado di sintetizzare l’acido alfa-linolenico, e quindi tutta la famiglia degli omega-3, e, se necessario, sono obbligati a ottenerlo dai vegetali e/o da animali che se ne cibano. Ma non tutti gli animali hanno necessità di ottenere EPA e DHA dal cibo.
I vertebrati erbivori terrestri, come le mucche, soddisfano le loro necessità di LC-PUFA omega-3 producendoli a partire dall’acido alfa-linolenico ottenuto mangiando le parti verdi delle piante.[19]
E ci sono animali che non necessitano di EPA e DHA, e ne sono praticamente privi. Tra questi gli insetti terrestri, nei quali si ritrovano solo bassissimi livelli di EPA, paragonabili a quelli delle vitamine. In essi l’EPA è sintetizzato a partire dall’ALA di origine alimentare e utilizzato per la produzione di eicosanoidi.[16]
Invece, gli insetti acquatici presentano elevati livelli di EPA, mentre il DHA è praticamente assente.[31]
Sono molto ricchi in EPA e DHA diverse classi di fitoplancton come le Cryptophyceae, le Dinophyceae, mentre sono molto ricche in EPA le Bacillariophyceae o diatomee. In generale le microalghe rappresentano i produttori primari di EPA e DHA. Gli ecosistemi acquatici sono quindi la principale fonte di LC-PUFA omega-3 nella biosfera.[2][28] EPA e DHA sintetizzati in queste alghe unicellulari sono trasferiti lungo la catena alimentare, passando dagli invertebrati ai pesci è poi agli animali terrestri, esseri umani inclusi. Dunque, dalle microalghe agli esseri umani.[16]
Benefici
Gli acidi grassi polinsaturi omega-3 sono componenti essenziali di una dieta salutare e bilanciata in quanto necessari nel corso dello sviluppo, a partire dalla vita fetale, e associati, nel corso della vita, a miglioramenti della salute e alla riduzione del rischio di malattia.[8][26][36]
Studi epidemiologici hanno ad esempio associato elevati livelli di assunzione di EPA e DHA con tassi di mortalità per malattie cardiovascolari, specialmente cardiache, più bassi di quelli attesi in soggetti sani, probabile conseguenza del miglioramento di molti fattori di rischio, in particolare dei livelli plasmatici dei trigliceridi, del colesterolo HDL e della proteina C-reattiva, e miglioramenti dei valori della pressione, sia sistolica che diastoliche, e della frequenza cardiaca.[1][27]
EPA e DHA si sono dimostrati utili anche nel trattamento di malattie quali l’artrite reumatoide, e potrebbero essere utili nel trattamento di altre condizioni infiammatorie quali l’asma, la psoriasi o le malattie infiammatorie croniche intestinali, grazie alla loro capacità di modulare molti aspetti dei processi infiammatori.[33]
Al contrario, gli LC-PUFA omega-3 sembrano avere effetti minimi o nulli sulla prevenzione e il trattamento del diabete mellito di tipo 2.[5]
Rapporto omega-3/omega-6
Molte prove epidemiologiche suggeriscono che il consumo di una dieta con un basso valore del rapporto omega-3/omega-6 abbia influenzato negativamente la salute umana, concorrendo alla promozione, probabilmente assieme a fattori quali il fumo e la sedentarietà, dello sviluppo delle principali classi di patologie.[8]
Sono stati infatti osservati tassi più bassi di incidenza di cancro, autoimmunità e malattia coronarica nelle popolazioni che consumano una dieta con un alto valore del rapporto omega-3/omega-6, in particolare negli Eschimesi, Giapponesi e in altre società dove è elevato il consumo di pesce.[20][37]
Nonostante ciò, la dieta di tipo occidentale è divenuta via via più ricca in acidi grassi saturi, povera in acidi grassi polinsaturi omega-3 e ricca in acidi grassi polinsaturi omega-6, con una rapporto omega-3/omega-6 compreso tra 1/10 e 1/20, quindi molto lontano dal rapporto raccomandato di 1:5.[33]
Il basso valore del rapporto omega-3/omega-6 è dovuto a diversi fattori, alcuni dei quali sono di seguito elencati.
- Sebbene gli alimenti vegetali selvatici siano in genere ricchi in omega-3, nell’agricoltura industriale le colture ricche in omega-6 hanno avuto molto più successo di quelle ricche in omega-3.[3]
- Il basso consumo di prodotti della pesca e di olio di pesce.[33]
- L’elevato consumo di animali allevati con mangimi a base di mais, quali polli, bovini e suini.
A questo va aggiunto anche il fatto che il contenuto in omega-3 di alcune specie di pesci allevate è più basso rispetto a quello delle controparti selvatiche.[9] - L’elevato consumo di oli ricchi in omega-6 e poveri in omega-3, come l’olio di cartamo, girasole, di semi di soia, e di mais.[4]
Nota: il rapporto omega-3/omega-6 non sembra avere influenza ne sulla prevenzione ne sul trattamento del diabete di tipo 2.[5]
Effetti a livello molecolare di EPA e DHA
Negli ultimi anni si stanno chiarendo i meccanismi molecolari alla base degli effetti funzionali attribuiti agli acidi grassi polinsaturi omega-3, in particolare a EPA e DHA, e la maggior parte di questi richiedono l’incorporazione dei due acidi grassi nei fosfolipidi di membrana.[23]
Gli omega-3 sono componenti strutturali delle membrane cellulari, dove svolgono un ruolo essenziale nel regolarne la fluidità.[35] Grazie a questo effetto gli omega-3, in particolare EPA e DHA, sono in grado di modulare le risposte cellulari dipendenti da proteine di membrana. Questo si è rivelato essere particolarmente importante nell’occhio, dove la presenza del DHA permette un’attività ottimale della rodopsina.[29] L’azione sulla fluidità di membrana è poi essenziale per gli animali che vivono in acque fredde, nei quali EPA e DHA svolgono anche una funzione di antigelo naturali.
EPA e DHA sono in grado di modificare la formazione delle zattere lipidiche, microdomini con una composizione lipidica specifica che possono agire come piattaforme per l’azione dei recettori e per l’inizio di vie di segnalazione intracellulare. Modificandone la formazione influenzano le vie di segnalazione intracellulare in tipi cellulari differenti, come i neuroni, le cellule del sistema immunitario e le cellule cancerose. In questo modo EPA e DHA sono in grado di modulare l’attivazione di fattori di trascrizione, come NF-κB, PPARs e SREBPs, e di conseguenza i pattern di espressione genica da essi regolati. Questo ruolo è centrale rispetto alla loro funzione di controllo del metabolismo degli acidi grassi e dei trigliceridi, dell’infiammazione e della differenziazione adipocitaria.[8]
ARA, EPA, e DHA sono substrati per la produzione di numerosi mediatori lipidici, tra cui spiccano gli eicosanoidi, molecole con un ruolo ben definito nella regolazione dell’infiammazione, immunità, aggregazione piastrinica, funzione renale e contrazione della muscolatura liscia.[21]
Gli eicosanoidi prodotti dall’acido arachidonico, che, dal punto di vista quantitativo, è il maggior substrato per la loro sintesi, hanno importanti ruoli fisiologici, ma un loro eccesso è stato associato a numerosi processi patologici.[8] L’aumento del contenuto di EPA e DHA nei fosfolipidi di membrana si accompagna a una riduzione del contenuto di ARA, a una riduzione nella produzione di mediatori lipidici derivanti da ARA, e a un aumento della produzione di mediatori lipidici derivanti dai due omega-3. In aggiunta, tra le molecole derivanti da EPA e DHA ci sono alcuni eicosanoidi analoghi a quelli derivati dall’acido arachidonico, sebbene dotati di minor attività biologica, le resolvine, e, per quanto riguarda DHA, le protectine e le maresine. Queste molecole sembrano essere responsabili di molte delle azioni antiinfiammatorie immuno-modulatrici attribuite ai due acidi grassi polinsaturi omega-3.[10]
E’ stato dimostrato che EPA e DHA possono svolgere un ruolo in forma libera. Sono infatti in grado di agire direttamente attraverso recettori di membrana accoppiati alle proteine G, modulandone l’attività o legandosi a specifici recettori nucleari, come il DHA su PPARα.[30]
Infine, riducono l’assorbimento degli acidi grassi polinsaturi omega-6, e, a livello enzimatico inibiscono competitivamente la ciclo ossigenasi e la lipossigenasi, e competono per le aciltransferasi.[3]
Fonti più importanti di EPA e DHA per l’uomo
In generale i pesci e gli invertebrati acquatici, come i crostacei e i molluschi, sono la fonte più importante di EPA e DHA per l’uomo.[3][9][36] Questi animali sono in grado di convertire l’acido alfa-linolenico in EPA e DHA oltre che di assumerlo con il cibo, quindi, in ultima analisi dal fitoplancton.[16] Inoltre, considerando il solo DHA, questi è presente in concentrazione elevata in molti oli di pesce, specialmente in quelli di pesci cresciuti in acque fredde. Si noti però che molti di questi oli sono ricchi anche di acidi grassi saturi.[24]
Per chi non mangia prodotti della pesca, il fegato degli animali terrestri ma anche la selvaggina dell’ordine dei Passeriformi rappresentano una buona fonte di EPA e DHA.[14][15]
Riguardo gli apporti giornalieri non è ancora chiaro quale siano i valori raccomandati. Nella tabella seguente sono riportati i valori suggeriti dalla FAO delle Nazioni Unite e dalla autorità europea per la sicurezza alimentare (EFSA).[11][12]
| Organizzazione | Categoria | Raccomandazione |
|---|---|---|
| FAO | Uomini adulti e donne adulte non gravide o non in allattamento | Almeno 250 mg di EPA + DHA al giorno |
| Donne gravide o in allattamento | Almeno 300 mg di EPA + DHA al giorno di cui almeno 200 mg dovrebbero essere di DHA | |
| Bambini di età compresa tra i 2 e i 4 anni | 100-150 mg di EPA + DHA al giorno | |
| Bambini dai 4 ai 6 anni | 150-200 mg di EPA + DHA al giorno | |
| Bambini dai 6 ai 10 anni | 200-250 mg di EPA + DHA al giorno | |
| EFSA | Uomini adulti e donne adulte non gravide | L’assunzione adeguata è di 250 mg di EPA + DHA al giorno |
| Donne gravide | Ulteriori 100-200 mg di DHA al giorno | |
| Neonati e bambini da 6 mesi a 2 anni | 100 mg di DHA al giorno | |
| Bambini dai 2 ai 18 anni | “Coerente con gli adulti” |
Omega-3 negli alimenti
Gli acidi grassi polinsaturi sono particolarmente sensibili all’ossidazione a seguito del riscaldamento. I vari processi cui è sottoposto il cibo nella fase di preparazione potrebbero quindi ridurne il contenuto.[3] Tuttavia questo è vero solo in parte. Negli alimenti i due acidi grassi polinsaturi omega-3 non sono presenti in forma chimica pura, ma per la maggior parte esterificati nei fosfolipidi di membrana, e, in questa forma, risultano molto meno suscettibili all’ossidazione.[9]
Quando si considera il contenuto in EPA e DHA negli alimenti, esprimerlo come percentuale degli acidi grassi totali anziché come contenuto assoluto, mg/g di peso umido, induce in un errore. Se ad esempio si considera un pesce grasso come il salmone, il suo contenuto assoluto di EPA + DHA è alto, circa 8 mg/g di peso umido, mentre se si esprime in percentuale si ottiene il 20%. Di contro il merluzzo atlantico presenta una percentuale di EPA + DHA di oltre il 40%, ma un contenuto assoluto inferiore a 3 mg/g di peso umido. In questo caso l’alta percentuale è dovuta al fatto che il pesce in esame è magro, mentre nei pesci grassi il contenuto in EPA + DHA è “diluito” dalle elevate riserve di acidi grassi presenti nel tessuto adiposo dell’animale.[17]
Se invece si esprime il contenuto di EPA + DHA in mg/g di prodotto, non si osserva alcuna riduzione a seguito della maggior parte dei trattamenti cui il cibo è sottoposto nella fase di preparazione.[16]
Bibliografia
- ^ a b AbuMweis S., Jew S., Tayyem R. Agraib L. Eicosapentaenoic acid and docosahexaenoic acid containing supplements modulate risk factors for cardiovascular disease: a meta-analysis of randomised placebo-control human clinical. J Hum Nutr Diet 2018;31(1):67-84. doi:10.1111/jhn.12493
- ^ Ahlgren G., Lundstedt L., Brett M., Forsberg C. Lipid composition and food quality of some freshwater phytoplankton for cladoceran zooplankters. J Plankton Res 1990;12(4):809-18. doi:10.1093/plankt/12.4.809
- ^ a b c d e f g Akoh C.C. and Min D.B. Food lipids: chemistry, nutrition, and biotechnology. 3th ed. 2008
- ^ Blasbalg T.L., Hibbeln J.R., Ramsden C.E., Majchrzak S..F, Rawlings R.R. Changes in consumption of omega-3 and omega-6 fatty acids in the United States during the 20th century. Am J Clin Nutr 2011;93(5):950-62. doi:10.3945/ajcn.110.006643
- ^ a b Brown T.J., Brainard J., Song F., Wang X., Abdelhamid A., Hooper L. Omega-3, omega-6, and total dietary polyunsaturated fat for prevention and treatment of type 2 diabetes mellitus: systematic review and meta-analysis of randomised controlled trials. BMJ 2019;366:l4697. doi:10.1136/bmj.l4697
- ^ a b c Buckley M.T., Racimo F., Allentoft M.E., et al. Selection in Europeans on fatty acid desaturases associated with dietary changes. Mol Biol Evol 2017;34(6):1307-1318. doi:10.1093/molbev/msx103
- ^ a b Burdge G.C., Wootton S.A. Conversion of α-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in young women. Br J Nutr 2002;88(4):411-420. doi:10.1079/BJN2002689
- ^ a b c d e f Calder P.C. Very long-chain n-3 fatty acids and human health: fact, fiction and the future. Proc Nutr Soc 2018 77(1):52-72. doi:10.1017/S0029665117003950
- ^ a b c d e f g h Chow Ching K. Fatty acids in foods and their health implication. 3th ed. 2008
- ^ a b Duvall M.G., Levy B.D. DHA- and EPA-derived resolvins, protectins, and maresins in airway inflammation. Eur J Pharmacol 2016;785:144-155. doi:10.1016/j.ejphar.2015.11.001
- ^ EFSA Panel on Dietetic Products, Nutrition, and Allergies (NDA). Scientific opinion on dietary reference values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. 2010. doi:10.2903/j.efsa.2010.1461
- ^ FAO. Global recommendations for EPA and DHA intake (As of 30 June 2014)
- ^ Fumagalli M., Moltke I., Grarup N., Racimo F., Bjerregaard P., Jørgensen M.E., Korneliussen T.S., Gerbault P., Skotte L., Linneberg A., Christensen C., Brandslund I., Jørgensen T., Huerta-Sánchez E., Schmidt E.B., Pedersen O., Hansen T., Albrechtsen A., Nielsen R.. Greenlandic Inuit show genetic signatures of diet and climate adaptation. Science 2015;349(6254):1343-7. doi:10.1126/science.aab2319
- ^ Gladyshev M.I., Makhutova O.N., Gubanenko G.A.; Rechkina E.A., Kalachova G.S., Sushchik N.N. Livers of terrestrial production animals as a source of long-chain polyunsaturated fatty acids for humans: an alternative to fish? Eur J Lipid Sci Technol 2015;117:1417-1421. doi:10.1002/ejlt.201400449
- ^ Gladyshev M.I., Popova O.N., Makhutova, O.N., Zinchenko, T.D., Golovatyuk, L.V., Yurchenko, Y.A., Kalachova, G.S., Krylov, A.V., Sushchik, N.N. Comparison of fatty acid compositions in birds feeding in aquatic and terrestrial ecosystems. Contemp Probl Ecol 2016;9:503-513. doi:10.1134/S1995425516040065
- ^ a b c d Gladyshev M.I. and Sushchik N.N. Long-chain omega-3 polyunsaturated fatty acids in natural ecosystems and the human diet: assumptions and challenges. Biomolecules 2019;9(9):485. doi:10.3390/biom9090485
- ^ Gladyshev M.I., Sushchik N.N., Tolomeev A.P., Dgebuadze Y.Y. Meta-analysis of factors associated with omega-3 fatty acid contents of wild fish. Rev Fish Biol Fish 2018;28,:277-299. doi:10.1007/s11160-017-9511-0
- ^ Kim H-Y. Novel metabolism of docosahexaenoic acid in neural cells. J Biol Chem 2007;282(26):18661-18665. doi:10.1074/jbc.R700015200
- ^ Kouba M., Mourot J. A review of nutritional effects on fat composition of animal products with special emphasis on n-3 polyunsaturated fatty acids. Biochimie 2011;93(1):13-7. doi:10.1016/j.biochi.2010.02.027
- ^ Kromann N., Green A. Epidemiological studies in the Upernavik district, Greenland. Incidence of some chronic diseases 1950-1974. Acta Med Scand 1980;208(5):401-6. doi:10.1111/j.0954-6820.1980.tb01221.x
- ^ a b Kuda O. Bioactive metabolites of docosahexaenoic acid. Biochimie 2017;136:12-20. doi:10.1016/j.biochi.2017.01.002
- ^ Lauritzen L., Hansen H.S., Jørgensen M.H., Michaelsen K.F. The essentiality of long chain n-3 fatty acids in relation to development and function of the brain and retina. Prog Lipid Res 2001;40(1-2):1-94. doi:10.1016/s0163-7827(00)00017-5
- ^ a b Lee J.M., Lee H., Kang S. and Park W.J. Fatty acid desaturases, polyunsaturated fatty acid regulation, and biotechnological advances. Nutrients 2016;8(1):23. doi:10.3390/nu8010023
- ^ Mason R.P., Sherratt S.C.R. Omega-3 fatty acid fish oil dietary supplements contain saturated fats and oxidized lipids that may interfere with their intended biological benefits. Biochem Biophys Res Commun 2017;483(1):425-429. doi:10.1016/j.bbrc.2016.12.127
- ^ Mathieson I., Lazaridis I., Rohland N., Mallick S., Patterson N., Roodenberg S.A., Harney E., Stewardson K., Fernandes D., Novak M., et al. Genome-wide patterns of selection in 230 ancient Eurasians. Nature 2015;528:499-503. doi:10.1038/nature16152
- ^ a b McCann J.C., Ames B.N. Is docosahexaenoic acid, an n-3 long-chain polyunsaturated fatty acid, required for development of normal brain function? An overview of evidence from cognitive and behavioral tests in humans and animals. Am J Clin Nutr 2005;82(2):281-95. doi:10.1093/ajcn.82.2.281
- ^ a b Mensink R.P., Zock P.L., Kester A.D., Katan M.B. Effects of dietary fatty acids and carbohydrates on the ratio of serum total to HDL cholesterol and on serum lipids and apolipoproteins: a meta-analysis of 60 controlled trials. Am J Clin Nutr 2003;77(5):1146-55. doi:10.1093/ajcn/77.5.1146
- ^ Muller-Navarra D.C. Biochemical versus mineral limitation in Daphnia. Limnol Oceanogr 1995;40:1209-1214. doi:10.4319/lo.1995.40.7.1209
- ^ a b Niu S.L., Mitchell D.C., Lim S.Y., Wen Z.M., Kim H.Y., Salem N. Jr, Litman B.J. Reduced G protein-coupled signaling efficiency in retinal rod outer segments in response to n-3 fatty acid deficiency. J Biol Chem 2004;279(30):31098-104. doi:10.1074/jbc.M404376200
- ^ Oh D.Y., Talukdar S., Bae E.J., Imamura T., Morinaga H., Fan WQ, Li P., Lu W.J., Watkins S.M., Olefsky J.M. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects. Cell 2010 142(5):687-698. doi:10.1016/j.cell.2010.07.041
- ^ Popova O.N., Haritonov A.Y., Sushchik N.N., Makhutova O.N., Kalachova G.S., Kolmakova A.A., Gladyshev M.I. Export of aquatic productivity, including highly unsaturated fatty acids, to terrestrial ecosystems via Odonata. Sci Total Environ 2017;581-582:40-48. doi:10.1016/j.scitotenv.2017.01.017
- ^ Salem N. Jr, Litman B., Kim H.Y., Gawrisch K. Mechanisms of action of docosahexaenoic acid in the nervous system. Lipids 2001;36(9):945-59. doi:10.1007/s11745-001-0805-6
- ^ a b c d Simopoulos A.P. The importance of the omega-6/omega-3 fatty acid ratio in cardiovascular disease and other chronic diseases. Exp Biol Med 2008;233(6):6746-88. doi:10.1016/S0753-3322(02)00253-6
- ^ Smith W., Mukhopadhyay R. Essential fatty acids: the work of George and Mildred Burr. J Biol Chem 2012;287(42):35439-35441. doi:10.1074/jbc.O112.000005
- ^ a b Stubbs C.D., Smith A.D. The modification of mammalian membrane polyunsaturated fatty acid composition in relation to membrane fluidity and function. Biochim Biophys Acta 1984;779(1):89-137. doi:10.1016/0304-4157(84)90005-4
- ^ a b c Tocher D.R., Betancor M.B., Sprague M., Olsen R.E., Napier J.A. Omega-3 long-chain polyunsaturated fatty acids, EPA and DHA: bridging the gap between supply and demand. Nutrients 2019;11(1):89. doi:10.3390/nu11010089
- ^ Yano K., MacLean C.J., Reed D.M., Shimizu Y., Sasaki H., Kodama K., Kato H., Kagan A. A comparison of the 12-year mortality and predictive factors of coronary heart disease among Japanese men in Japan and Hawaii. Am J Epidemiol 1988;127(3):476-87. doi:10.1093/oxfordjournals.aje.a114824
- ^ Williams C.M., Burdge G. Long-chain n-3 PUFA: plant v. marine sources. Proc Nutr Soc 2006;65(1):42-50. doi:10.1079/pns2005473