L’acido linoleico (LA) è un acido grasso, dunque un acido carbossilico, che presenta una catena carboniosa lineare formata da diciotto atomi di carbonio e due doppi legami
Il suo nome deriva dalla parola latina linon, che significa lino, e oleico, che significa olio.
Fu isolato da Sacc F. nel 1844 dall’olio di lino, la sua struttura fu chiarita da Hilditch T.P. e colleghi nel 1939, mentre la sintesi si deve al lavoro di Raphael R.A. e Sondheimer F. nel 1950.[9][19][21]
Molti animali, uomo compreso, non sono in grado di sintetizzarlo. Per questi animali l’acido linoleico e l’acido alfa-linolenico (ALA), il precursore degli acidi grassi polinsaturi omega-3 o acidi grassi omega-3, sono acidi grassi essenziali, ossia acidi grassi che devono essere assunti con l’alimentazione.[24] Inoltre, in caso di sua assenza nella dieta, anche gli altri acidi grassi polinsaturi omega-6, di cui è il capostipite, ossia l’acido gamma-linolenico, l’acido diomo-gamma-linolenico, l’acido arachidonico o ARA e l’acido adrenico divengono essenziali, e per questo sono detti acidi grassi condizionatamente essenziali.[3]
Al pari degli altri acidi grassi, in natura raramente è presente in forma libera essendo per la maggior parte legato tramite legame estere ad altre molecole organiche come steroli, glicerolo e glicerolo-3-fosfato a formare lipidi più complessi, quali esteri degli steroli, ad esempio gli esteri del colesterolo, trigliceridi e fosfolipidi.
Nell’uomo è particolarmente abbondante nel tessuto adiposo e nelle lipoproteine plasmatiche.
Svolge diverse funzioni sia direttamente che indirettamente attraverso suoi metaboliti. Può essere utilizzato come fonte di energia. E’ un componente strutturale delle membrane cellulari. A livello epidermico è coinvolto nel mantenimento della barriera transdermale all’acqua.[27] Nelle piante terrestri vascolari e nel fitoplancton può essere desaturato a dare l’acido alfa-linolenico. Al pari di ARA e dell’acido docosaesaenoico o DHA, un acido grasso omega-3, è il precursore di mediatori lipidici bioattivi. Infine, è stato dimostrato che l’assunzione di LA con dieta è inversamente correlata al rischio di malattia coronarica quando va a sostituire gli acidi grassi saturi o i carboidrati.[7]
E’ il più abbondante tra gli acidi grassi polinsaturi assunti con l’alimentazione di tipo occidentale, ed è l’unico la cui assunzione è notevolmente aumentata, avendo raggiunto, in media, più del 7% dell’apporto energetico giornaliero, mentre quella degli altri acidi grassi omega-6 e omega-3 è rimasta relativamente costante fin dai primi del 1900, inferiore all’1% dell’apporto energetico giornaliero.[2][25] L’elevato apporto di acido linoleico ha portato il rapporto tra l’assunzione di acidi grassi omega-6 e omega-3 da 4:1 fino a 16:1.[23]
Una sua deficienza provoca ritardo nella crescita e nella guarigione delle ferite, dermatiti, problemi riproduttivi, fegato grasso e polidipsia. Tale deficienza è estremamente rara grazie alla sua abbondanza nella dieta di tipo occidentale, e quindi anche nel latte materno, e alla sua presenza nelle formule per bambini.[3]
Le fonti migliori per l’uomo sono l’olio di soia, di mais, di girasole, di canola e di cartamo.[3][27]
Indice
- Proprietà
- Sintesi
- Distribuzione tissutale
- Metaboliti
- Funzioni
- Fonti alimentari
- Le nuove cultivar
- Bibliografia
Proprietà
L’acido linoleico ha un peso molecolare di 280,447 g/mol, formula molecolare C18H32O2, formula condensata HOOC(CH2)7CH=CHCH2CH=CH(CH2)4CH3, nome IUPAC (9Z,12Z)-octadeca-9,12-dienoic acid, e abbreviazione 18:2n-6.[18]
La sua base coniugata è detta linoleato, ha formula condensata C18H31O2–, ed è la forma in cui, a pH fisiologico, la forma libera dell’acido grasso è presente nei sistemi biologici.
Poiché la catena carboniosa ha due doppi legami cis, nelle posizioni 9 e 12, l’acido linoleico appartiene al gruppo degli acidi grassi insaturi. Ed essendo il primo doppio legame, rispetto all’estremità metilica, in posizione 6, appartiene anche al gruppo degli acidi grassi polinsaturi omega-6 o acidi grassi omega-6.[1]
In forma purificata si presenta come un liquido da incolore a paglierino, con un punto di fusione pari a 5 ° C (23 °F; 268,15 K) e un punto di ebollizione di 230 °C (446 °F; 503,15 K) a 16 mm Hg.[18]
I numeri CAS, PubChem e CE sono rispettivamente 60-33-3, 5280450 e 200-470-9.[18]
Sintesi
L’acido linoleico è sintetizzato dall’acido oleico, un acido grasso insaturo a 18 atomi di carbonio e un doppio legame cis in posizione 9 rispetto all’estremità metilica, dunque un acido grasso omega-9.
La reazione, catalizzata dalla delta-12 desaturasi (EC 1.14.19.6), comporta all’inserzione di un secondo doppio legame cis tra i carboni 12 e 13, ed è il passaggio chiave nella sintesi degli acidi grassi grassi polinsaturi.[15]
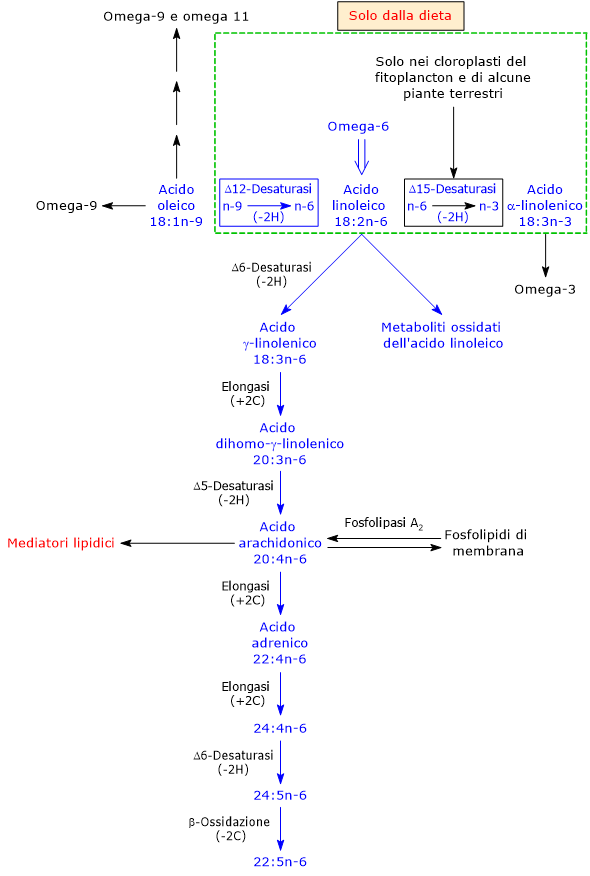
Si noti che la delta-12 desaturasi catalizza il passaggio da un acido grasso omega-9 a un acido grasso omega-6.
Per molto tempo si è ritenuto che l’enzima fosse presente solamente nei batteri, protozoi e piante, e che solamente questi organismi fossero in grado di sintetizzare l’acido linoleico.[5] Tuttavia nel 1961 fu dimostrato che anche un insetto, lo scarafaggio americano Periplaneta americana, e quindi un animale, era in grado di sintetizzarlo. In seguito la sua sintesi fu dimostrata essere presente anche in altri insetti e altri invertebrati, tra cui diversi Nematodi, Crostacei e Acari.[15]
Distribuzione tissutale
Con l’acido palmitico e l’acido oleico è uno dei più abbondanti acidi grassi presenti nei trigliceridi del tessuto adiposo e delle lipoproteine plasmatiche, dove la sua concentrazione riflette l’apporto con la dieta.[3] A questo riguardo, considerando gli USA, il grande aumento della sua assunzione con la dieta è stato accompagnato da un aumento del suo contenuto nel tessuto adiposo, aumento stimato superiore al 135%.[8]
Data la sua abbondanza e suscettibilità all’ossidazione, l’acido linoleico è l’acido grasso più comunemente ossidato nelle LDL.[11] E l’ossidazione dei lipidi delle LDL è un marker di rischio per la malattia coronarica.[16]
Sebbene essenziale per lo sviluppo neurologico fetale, è presente in bassa concentrazione nel cervello, meno del 2% di tutti gli acidi grassi, percentuale molto inferiore rispetto a quelle dell’acido palmitico, dell’acido stearico, dell’acido oleico, del DHA e di ARA, che insieme rappresentano circa l’84% degli acidi grassi presenti.[25][26]
Nell’epidermide è l’acido grasso polinsaturo più abbondante.[3]
Metaboliti
L’acido linoleico è il capostipite della famiglia degli acidi grassi omega-6.
Può essere desaturato a dare l’acido alfa-linolenico, il capostipite degli acidi grassi omega-3. La reazione è catalizzata dalla delta-15 desaturasi (EC 1.14.19.25) che è presente solamente nei plastidi e nel reticolo endoplasmatico del fitoplancton e delle piante terrestri vascolari.[1][3] Si noti che la delta-15 desaturasi catalizza il passaggio da un acido grasso omega-6 a un acido grasso omega-3.
E’ il precursore di mediatori lipidici bioattivi ad azione autocrina e paracrina che intervengono nella regolazione di vari processi cellulari.[27] Una volta rilasciato dai fosfolipidi di membrana, può andare incontro a ossidazione enzimatica, in reazioni catalizzate dalla 12-lipoossigenasi (EC 1.13.11.31), dalla 15-lipossigenasi (EC 1.13.11.33), dalle cicloossigenasi (EC 1.14.99.1), dagli enzimi della famiglia del citocromo P450, o dalla epossi idrolasi solubile (EC 3.3.2.10), quindi gli stessi enzimi che intervengono nel metabolismo di ARA e DHA.[22] L’acido linoleico può inoltre subire un’ossidazione mediata da radicali liberi.[25] I metaboliti prodotti, come i derivati epossidici e mono- di- e triidrossilati detti OXLAMs, da oxidized linoleic acid metabolites, intervengono nella segnalazione cellulare e nella regolazione del dolore e dell’infiammazione.[22]
ARA è il precursore sia di mediatori con attività pro-infiammatorie, pro-trombotiche e aterogeniche, che di mediatori con attività antiinfiammatorie, vasodilatatrici e favorenti la risoluzione dell’infiammazione. E la possibile conversione dell’acido linoleico in acido ARA ha attirato l’attenzione della comunità scientifica sull’acido linoleico. Fu infatti ipotizzato che limitandone l’assunzione con la dieta si potessero ridurre i livelli tissutali di ARA.
Tuttavia, almeno per soggetti che consumino una normale dieta occidentale, questo non sembra accadere poiché la conversione in ARA è molto modesta, tra lo 0,3% e lo 0,6%, al pari di quanto accade per la conversione di ALA in DHA.[20] Inoltre è stato suggerito che il profilo dei mediatori lipidici, come le risposte infiammatorie a una dieta ricca di acido linoleico siano influenzate dal genotipo FADS1, gene FADS1 che codifica per la delta-5 desaturasi (EC 1.14.19.44), enzima che catalizza la seconda reazione di desaturazione della via di sintesi di ARA, ossia la desaturazione dell’acido diomo-gamma-linolenico a dare ARA.[13]
Funzioni
Per la maggior parte degli animali, compreso l’uomo, l’acido linoleico è un acido grasso essenziale. Le sue funzioni sono molto varie, e sono dovute alla sua azione come tale o attraverso i suoi metaboliti.
- Può essere utilizzato come fonte di energia, e dunque andare incontro a beta-ossidazione.[27] Considerando ad esempio il cervello, sebbene entri a una velocità comparabile a quella del DHA, di ARA e di altri acidi grassi, ARA e DHA sono per la maggior parte incorporati nei fosfolipidi di membrana, mentre quasi il 60% dell’acido linoleico va incontro a beta-ossidazione. Inoltre parte dell’acetato prodotto è utilizzato per la sintesi del colesterolo nel cervello.
- Come componente dei fosfolipidi di membrana concorre al mantenimento di un adeguato grado di fluidità delle membrane.[27]
- A livello epidermico, come componente degli sfingolipidi, concorre alla formazione della barriera che si oppone al passaggio dell’acqua.[28]
- E’ in grado di legarsi a PPARα attivandolo.[8]
Questo fattore di trascrizione ha un ruolo importante nella regolazione del metabolismo. Ad esempio, inibisce della trascrizione di geni che codificano per enzimi coinvolti nella lipogenesi, e attiva la trascrizione di geni che codificano per enzimi della lipolisi e della beta-ossidazione sia mitocondriale che lisosomiale.[6] Queste azioni possono contribuire alla capacità dell’acido linoleico di ridurre i livelli plasmatici del colesterolo totale e delle LDL, concorrendo così alla riduzione del rischio cardiovascolare.[7]
Fonti alimentari
Negli USA nel corso del ventesimo secolo il consumo degli oli vegetali ricchi di acido linoleico è aumentato di circa 20 volte.[2][17] Tale aumento è stato conseguenza:
- della selezione di cultivar che producono semi ad alto contenuto di acido linoleico, in particolare soia e mais;[2]
- di un’aumentata disponibilità commerciale degli oli derivati;
- delle raccomandazioni di aumentarne il consumo come aiuto per abbassare i livelli di colesterolo ematico, raccomandazioni che seguirono, a metà degli anni ’50 del secolo scorso, gli studi del fisiologo americano Ancel Keys.[12]
Questo ha portato alle attuali assunzioni che coprono circa il 6-7% del fabbisogno energetico giornaliero, in confronto ai valori pre-1930 che erano compresi tra 1 e il 2% del fabbisogno energetico giornaliero.[25]
Negli USA l’olio di soia ne rappresenta la principale fonte, apportandone fino a circa il 45% del totale.[27]
Altri alimenti ricchi sono gli oli di mais, girasole, cartamo, e canola e i semi corrispondenti, nonché noci, arachidi, e semi di cotone e sesamo.[3]
Anche gli animali alimentati con diete ricche di acido linoleico possono esserne buone fonti per l’uomo.
Tra gli acidi grassi polinsaturi presenti nei cibi è il più abbondante. I valori più alti si ritrovano di nuovo nell’olio di soia, dove costituisce fino all’88% degli acidi grassi polinsaturi, mentre negli altri cibi più comunemente consumati supera il 70% del totale degli acidi grassi polinsaturi. Ad esempio, nelle carni di maiale, manzo e pollo il contenuto è compreso tra il 75 e l’85% del totale degli acidi grassi polinsaturi, mentre nelle uova supera l’80%. Ed è il principale acido grasso polinsaturo anche in quegli alimenti che hanno un contenuto in grassi molto basso, come la frutta, i cereali e le verdure. L’eccezione sono i fagioli dove rappresenta tra il 40 e il 50% degli acidi grassi polinsaturi.[2][27]
Le nuove cultivar
In Natura, l’acido linoleico è prodotto in concentrazioni paragonabili a quelle dell’acido alfa-linolenico.
Dagli anni trenta del secolo scorso sono state selezionate cultivar che producono semi ad alto contenuto di acido linoleico. Tuttavia, negli ultimi anni il trend sta cambiando a seguito della selezione di cultivar che producono semi con un contenuto decisamente più basso rispetto alle precedenti, e dove, nella maggior parte dei casi l’acido linoleico è stato sostituito dall’acido oleico.[25]
Questo ha permesso di ottenere oli di girasole e di cartamo ad alto contenuto non di acido linoleico, ma di acido oleico, e anche semi di soia ad alto contenuto di acido oleico. E a mano a mano che le nuove cultivar andranno a sostituire le precedenti presumibilmente si avrà una riduzione dell’apporto di acido linoleico a favore dell’acido oleico.[10] Si potrebbe quindi osservare uno spostamento verso livelli di assunzione di acido linoleico paragonabili a quelli di inizio ventesimo secolo. Questa transizione potrebbe apportare benefici per la salute in quanto il consumo di acido oleico è associato a miglioramenti dei livelli del colesterolo HDL e soprattutto è caratteristica della dieta mediterranea un buon apporto di questo acido grasso monoinsaturo, sebbene in forma di olio di oliva extravergine, la pietra angolare di questo tipo di alimentazione.[10]
Bibliografia
- ^ a b Akoh C.C. and Min D.B. Food lipids: chemistry, nutrition, and biotechnology. 3th Edition. CRC Press, Taylor & Francis Group, 2008
- ^ a b c d Blasbalg T. L., Hibbeln J. R., Ramsden C. E., Majchrzak S. F. & Rawlings R. R. Changes in consumption of omega-3 and omega-6 fatty acids in the United States during the 20th century. Am J Clin Nutr 2011;93(5):950-962. doi:10.3945/ajcn.110.006643
- ^ a b c d e f g Chow Ching K. Fatty acids in foods and their health implication. 3th Edition. CRC Press, Taylor & Francis Group, 2008
- ^ DeMar J.C. Jr, Lee H.J., Ma K., Chang L., Bell J.M., Rapoport S.I., Bazinet R.P. Brain elongation of linoleic acid is a negligible source of the arachidonate in brain phospholipids of adult rats. Biochim Biophys Acta 2006;1761(9):1050-9. doi:10.1016/j.bbalip.2006.06.006
- ^ De Renobales M., Ryan R.O., Heisler C.R., McLean D.L., Blomquist G.J. Linoleic acid biosynthesis in the pea aphid, Acyrthosiphon pisum (Harris). Arch Insect Biochem Physiol 1986:3(2);193-203.
- ^ Desvergne B., Wahli W. Peroxisome proliferator-activated receptors: nuclear control of metabolism. Endocr Rev 1999;20(5):649-88. doi:10.1210/edrv.20.5.0380
- ^ a b Farvid M.S., Ding M., Pan A., Sun Q., Chiuve S.E., Steffen L.M., Willett W.C., Hu F.B. Dietary linoleic acid and risk of coronary heart disease: a systematic review and meta-analysis of prospective cohort studies. Circulation 2014;130:1568-1578. doi:10.1161/CIRCULATIONAHA.114.010236
- ^ a b Guyenet S.J., Carlson S.E. Increase in adipose tissue linoleic acid of US adults in the last half century. Adv Nutr 2015;6(6):660-664. doi:https://DOI.org/10.3945/an.115.009944
- ^ Hilditch T.P. and Jasperson H. The constitution of the linoleic acid of seed fats. J Soc Chem Ind 1939;58(26). doi:10.1002/jctb.5000582613
- ^ a b Jandacek R.J. Linoleic acid: a nutritional quandary. Healthcare 2017;5(2):25. doi:10.3390/healthcare5020025
- ^ Jira W., Spiteller G., Carson W., Schramm A. Strong increase in hydroxy fatty acids derived from linoleic acid in human low density lipoproteins of atherosclerotic patients. Chem Phys Lipids 1998;91(1):1-11. doi:10.1016/s0009-3084(97)00095-9
- ^ Keys A., Anderson J.T., Grande F. Prediction of serum-cholesterol responses of man to changes in fats in the diet. Lancet 1957;273(7003):959-66. doi:10.1016/s0140-6736(57)91998-0
- ^ Lankinen M.A., Fauland A., Shimizu B., Agren J., Wheelock C.E., Laakso M., Schwab U., and Pihlajamaki J. Inflammatory response to dietary linoleic acid depends on FADS1 genotype. Am J Clin Nutr 2019;109:165-175. doi:10.1093/ajcn/nqy287
- ^ Louloudes S.J., Kaplanis J.N., Robbins W. E., Monroe R.E. Lipogenesis from C14-acetate by the American cockroach. Ann Entomol Soc Am 1961;54(1):99-103. doi:10.1093/aesa/54.1.99
- ^ a b Malcicka M., Visser B., Ellers J. An evolutionary perspective on linoleic acid synthesis in animals. Evol Biol 2018;45:15-26. doi:10.1007/s11692-017-9436-5
- ^ Meisinger C., Baumert J., Khuseyinova N., Loewel H., Koenig W. Plasma oxidized low-density lipoprotein, a strong predictor for acute coronary heart disease events in apparently healthy, middle-aged men from the general population. Circulation 2005;112(5):651-7. doi:10.1161/CIRCULATIONAHA.104.529297
- ^ Micha R., Khatibzadeh S., Shi P., Fahimi S., Lim S., Andrews K.G., Engell R.E., Powles J., Ezzati M., Mozaffarian D.; Global Burden of Diseases Nutrition and Chronic Diseases Expert Group NutriCoDE. Global, regional, and national consumption levels of dietary fats and oils in 1990 and 2010: a systematic analysis including 266 country-specific nutrition surveys. BMJ 2014;348:g2272. doi:10.1136/bmj.g2272
- ^ a b c National Center for Biotechnology Information. PubChem Compound Summary for CID 5280450, Linoleic Acid. https://pubchem.ncbi.nlm.nih.gov/compound/Linoleic-Acid. Accessed Jan. 19, 2024
- ^ Raphael R.A., Sondheimer F. The synthesis of long-chain aliphatic acids from acetylenic compounds. Part III. The synthesis of linoleic acid. J Chem Soc 1950:2100-2103. doi:10.1039/jr9500002100
- ^ Rett B.S. and Whelan J. Increasing dietary linoleic acid does not increase tissue arachidonic acid content in adults consuming Western-type diets: a systematic review. Nutr Metab (Lond) 2011;8:36. doi:10.1186/1743-7075-8-36
- ^ Sacc F. Ueber das Leinöl, seine physicalischen und chemischen Eigenscharften und seine Oxydationsproducte”. Liebig Annalen 1844;51;213-230.
- ^ a b Schuster S. Johnson C.D, Hennebelle M., Holtmann T., Taha A.Y., Kirpich I.A., Eguchi A., Ramsden C.E., Papouchado B.G., McClain C.J., Feldstein A.E. Oxidized linoleic acid metabolites induce liver mitochondrial dysfunction, apoptosis and NLRP3 activation in mice. J Lipid Res 2018;59(9):1597-1609. doi:10.1194/jlr.M083741
- ^ Simopoulos A.P. The importance of the omega-6/omega-3 fatty acid ratio in cardiovascular disease and other chronic diseases. Exp Biol Med 2008;233(6):6746-88. doi:10.1016/S0753-3322(02)00253-6
- ^ Smith W., Mukhopadhyay R. Essential fatty acids: the work of George and Mildred Burr. J Biol Chem 2012;287(42):35439-35441. doi:10.1074/jbc.O112.000005
- ^ a b c d e Taha A.Y. Linoleic acid-good or bad for the brain? NPJ Sci Food 2020;4:1. doi:10.1038/s41538-019-0061-9
- ^ Taha A.Y., Cheon Y., Ma K., Rapoport S.I., Rao JS.. Altered fatty acid concentrations in prefrontal cortex of schizophrenic patients. J Psychiatr Res 2013;47(5):636-43. doi:10.1016/j.jpsychires.2013.01.016
- ^ a b c d e f g Whelan J. and Fritsche K. Linoleic acid. Adv Nutr 2013;4(3): 311-312. doi:10.3945/an.113.003772
- ^ Ziboh V.A. Prostaglandins, leukotrienes, and hydroxy fatty acids in epidermis. Semin Dermatol 1992;11(2):114-20