Gli acidi grassi trans o grassi trans o TFA, acronimo dell’inglese trans fatty acids, sono acidi grassi insaturi, una sottoclasse di lipidi, con almeno un doppio legame in configurazione trans.
I doppi legami carbonio-carbonio hanno una conformazione planare e quindi possono essere considerati come dei piani ai cui lati opposti si attacca e prosegue la catena di atomi di carbonio. “L’ingresso” e “l’uscita” della catena può avvenire sullo stesso lato del piano, e in questo caso il doppio legame è detto in configurazione cis, o su lati opposti, e in quel caso si parla di configurazione trans. Questo è un esempio di isomeria geometrica o isomeria cis-trans.
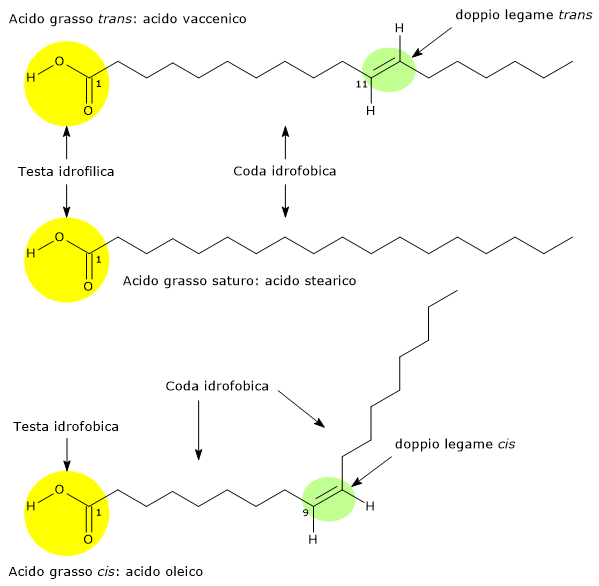
Gli acidi grassi insaturi più comunemente hanno i loro doppi legami in configurazione cis; l’altra configurazione meno comune è appunto la trans.
Il legame cis determina una curvatura nella catena carboniosa dell’acido grasso, mentre la geometria del legame trans raddrizza la catena, impartendo alla molecola una struttura più simile a quella degli acidi grassi saturi.
Indice
- Proprietà dei grassi ricchi in acidi grassi trans
- Origine
- Isomeri
- Effetti sulla salute
- Acidi grassi trans: esempi di legislazione in diversi paesi
- Fonti alimentari
- Bibliografia
Proprietà dei grassi ricchi in acidi grassi trans
Di seguito alcune caratteristiche distintive dei grassi a elevato tenore di acidi grassi trans, particolarmente vantaggiose per produrre margarine e grassi da pasticceria, ristorazione commerciale e per i processi di lavorazione industriale.
- Le molecole curve non possono impacchettarsi facilmente mentre quelle lineari possono farlo.
Ciò significa che i grassi trans concorrono, assieme ai geometricamente simili acidi grassi saturi, alla compattezza del grasso in cui si trovano conferendogli un punto di fusione più alto.
Innalzare il punto di fusione dei grassi significa che è possibile convertirli dalla forma liquida a quella semisolida o solida a temperatura ambiente.
Nota: gli acidi grassi trans tendono a essere meno solidi rispetto agli acidi grassi saturi. - Hanno, oltre a un punto di fusione, anche consistenza e gusto simili a quelli del burro.
- Si conservano a lungo a temperatura ambiente.
- Non vanno incontro a variazioni di sapore.
- Sono stabili durante la frittura.
Origine
Gli acidi grassi trans presenti nella dieta possono essere di origine industriale, casalinga, vegetale o animale.
- Nei paesi industrializzati la maggior parte dei grassi trans consumati nella dieta, negli Usa circa l’80% del totale, sono prodotti industrialmente, in quantità variabili, nel corso della parziale idrogenazione di oli alimentari ricchi di acidi grassi insaturi.
- Sono prodotti a livello casalingo durante la frittura utilizzando oli vegetali contenenti acidi grassi insaturi.
- Derivano dalla trasformazione batterica nel rumine dei ruminanti degli acidi grassi insaturi ingeriti dagli animali.
- Un’altra fonte naturale è rappresentata da alcune piante come porri, piselli, lattuga e spinaci che contengono l’acido trans-3-esadecenoico, e l’olio di colza dove sono presenti l’acido brassidico (22:1∆13t) e l’acido gondoico (C20:1∆11t). In queste alimenti i grassi trans sono presenti in piccole quantità.
- Piccolissime quantità, inferiori al 2%, si formano nel corso della deodorizzazione degli oli vegetali. Si tratta di un processo necessario nella raffinazione degli oli commestibili nel corso del quale si formano piccole quantità di acidi grassi trans con più di due doppi legami. Questi isomeri sono presenti anche nei cibi fritti e in quantità elevate in alcuni oli vegetali parzialmente idrogenati.
Acidi grassi trans industriali
L’idrogenazione è una reazione chimica nella quale l’idrogeno gassoso reagisce, in presenza di un catalizzatore, con una molecola.
L’idrogenazione degli acidi grassi insaturi consiste nell’addizione di atomi di idrogeno ai doppi legami presenti lungo la catena carboniosa degli acidi grassi. La reazione avviene in presenza di catalizzatori metallici ed è favorita dal riscaldamento degli oli vegetali in cui sono presenti i suddetti acidi grassi.
La parziale idrogenazione degli oli vegetali
Il processo di idrogenazione venne scoperto nel 1897 dal francese Paul Sabatier, premio Nobel per la chimica, insieme con il collega francese Victor Grignard, utilizzando come catalizzatore il nickel.
La parziale idrogenazione degli oli vegetali venne sviluppata nel 1903 da un chimico tedesco, Wilhelm Normann, che depositò un brevetto britannico intitolato “Process for converting unsaturated fatty acids or their glycerides into saturated compounds”. Il termine acidi grassi trans comparve per la prima volta nella Remark column della quinta edizione di “Standard Tables of Food Composition” in Giappone.
Nella parziale idrogenazione si verifica una saturazione incompleta dei doppi legami lungo la catena carboniosa dell’acido grasso insaturo. Ad esempio, per quanto riguarda l’olio di pesce il contenuto in acidi grassi trans in assenza di idrogenazione e in caso di forte idrogenazione è rispettivamente dello 0,5 e 3,6% mentre nel parziale idrogenazione è e del 30%.
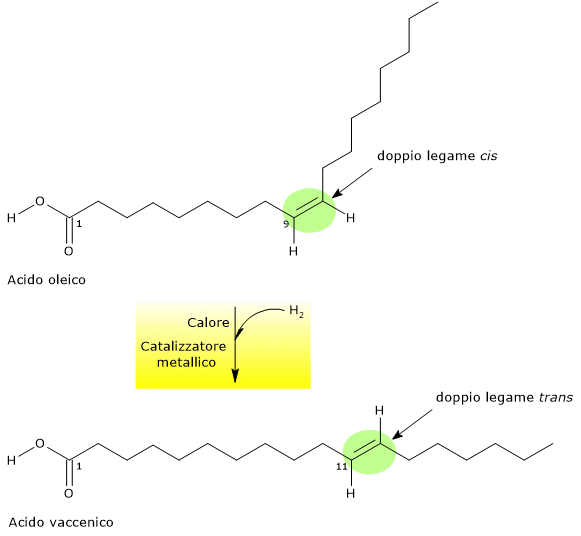
Ma, cosa più importante, alcuni dei doppi legami che restano possono cambiare posizione lungo la catena e produrre isomeri geometrici e di posizione, ossia i doppi legami possono essere modificati sia nella posizione che nella conformazione, con formazione appunto dei legami trans.
Inoltre si verificano anche le seguenti modificazioni.
- Gran parte dell’acido alfa-linolenico presente, l’acido grasso polinsaturo omega-3 base delle piante, viene distrutto.
- Si formano monomeri ciclici e dimeri intramolecolari lineari.
Gli oli vegetali parzialmente idrogenati furono sviluppati per la produzione di grassi vegetali, un’alternativa più economica rispetto ai grassi animali. Infatti tramite questo processo, oli come quello di semi di lino, semi di cotone, germe di grano, soia, mais, girasole, sesamo, cartamo e vinacciolo, ricchi in acidi grassi insaturi, sono convertiti in grassi semisolidi.
Il primo olio idrogenato fu l’olio di semi di cotone negli USA nel 1911 per la produzione di grasso vegetale per pasticceria.
Negli anni ’30 la parziale idrogenazione divenne popolare con lo sviluppo della margarina.
Attualmente negli USA sono prodotte 2,7-3,6 milioni di tonnellate di oli idrogenati all’anno.
Acidi grassi trans dai ruminanti
Gli acidi grassi trans di origine animale sono prodotti dai batteri presenti nel rumine dei ruminanti, ad esempio mucche, pecore e capre, utilizzando come substrato una parte della relativamente piccola quantità degli acidi grassi insaturi contenuti negli alimenti di cui si nutrono, quindi mangimi, piante ed erbe.
E, considerando un animale che viva almeno un anno e abbia la possibilità di pascolare e/o mangiare fieno, esiste una variabilità stagionale che interessa gli acidi grassi insaturi assunti e i grassi trans prodotti. Infatti, in estate e primavera i pascoli possono contenere più acidi grassi insaturi rispetto ai mangimi che gli animali consumano durante l’inverno.
Si ritrovano di seguito in piccole ma significative quantità nei trigliceridi della carne e dei prodotti lattiero-caseari non magri, dove costituiscono tipicamente meno del 5% del totale degli acidi grassi.
Nei trigliceridi, tali acidi grassi sono localizzati in posizione sn-1 e sn-3 della molecola, mentre nelle margarine e negli altri prodotti idrogenati di origine industriale sembrano essere concentrati in posizione sn-2.
Gli acidi grassi trans prodotti dai ruminanti sono principalmente acidi grassi monoinsaturi, con un numero di atomi di carbonio compreso tra 16 e 18, e costituiscono una piccola percentuale degli acidi grassi trans assunti con l’alimentazione (vedi sotto).
Isomeri
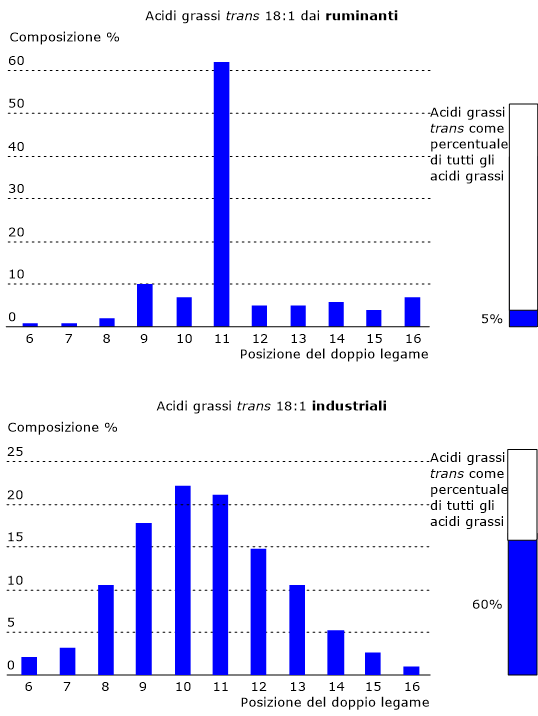
Sia per gli acidi grassi trans industriali che di origine animale, il gruppo più importante è rappresentato dagli isomeri trans del C18:1, ossia molecole contenenti 18 atomi di carbonio e un doppio legame trans la cui posizione varia tra il carbonio Δ6 e quello Δ16, con gli isomeri più comuni per entrambe le fonti con il doppio legame in posizione tra Δ9 e Δ11.
Tuttavia, sebbene una stessa molecola possa essere presente sia nel gruppo di derivazione industriale che animale, esiste una considerevole differenza quantitativa. Ad esempio, nel gruppo prodotto nei ruminanti, l’acido vaccenico (C18:1Δ11t) costituisce oltre il 60% degli isomeri trans-C18:1, mentre in quelli industriali l’acido elaidico (C18:1Δ9t) rappresenta il 15-20%, e il C18:1Δ10t e l’acido vaccenico oltre il 20% ciascuno.
Effetti sulla salute
Gli acidi grassi trans che derivano dai ruminanti, nelle quantità effettivamente consumate nella dieta, non sono pericolosi per la salute umana.
Al contrario, il consumo dei grassi trans industriali non ha effetti benefici evidenti ne alcun valore intrinseco, oltre al loro contributo calorico, e, dal punto di vista della salute è solo dannoso, avendo effetti nocivi su:
- livelli dei lipidi sierici;
- cellule endoteliali;
- processo infiammatorio;
- altri fattori di rischio per le malattie cardiovascolari.
Inoltre sono associati positivamente con il rischio di cardiopatia coronarica, e di morte improvvisa per cause cardiache e diabete.
Nota: nel proseguo dell’articolo, se non diversamente specificato, ci si riferirà agli acidi grassi trans industriali, che verranno indicati semplicemente come acidi grassi trans o grassi trans.
Effetti a livello plasmatico
I livelli plasmatici del colesterolo LDL e del colesterolo HDL sono marcatori di rischio ben documentati per lo sviluppo di malattia coronarica o CHD, acronimo dell’inglese coronary heart disease:
- elevati livelli di colesterolo LDL sono associati con un’aumentata incidenza di malattia cardiaca ischemica;
- elevati livelli di colesterolo HDL si associano a una ridotta incidenza del rischio.
Per questo motivo il rapporto tra il livello del colesterolo totale e del colesterolo HDL è spesso usato come indicatore di rischio combinato per questi due componenti in relazione allo sviluppo della malattia cardiaca: maggiore è il rapporto, maggiore è il rischio.
I grassi trans hanno effetti nocivi sui lipidi sierici. Questi effetti sono stati valutati in numerosi studi di alimentazione controllata nei quali veniva effettuata una sostituzione isocalorica di acidi grassi saturi o cis-insaturi con grassi trans. E’ stato dimostrato che tale sostituzione:
- aumenta livelli del colesterolo LDL;
- riduce quelli del colesterolo HDL, a differenza degli acidi grassi saturi che invece aumentano i livelli di colesterolo HDL se utilizzati come sostituti in studi analoghi;
- aumenta il rapporto tra colesterolo totale e colesterolo HDL, fino a valori pari a circa il doppio di quelli ottenuti con acidi grassi saturi, e, sulla base di questo solo effetto, è stato stimato che gli acidi grassi trans provochino circa il 6% degli eventi coronarici negli Stati Uniti.
Inoltre gli acidi grassi trans:
- causano un pericoloso aumento delle LDL piccole e dense, che sono associate a un notevole aumento del rischio di CHD, anche in presenza di colesterolo LDL relativamente normale;
- aumentano i livelli ematici dei trigliceridi, e questo è un fattore di rischio indipendente per la CHD;
- aumentano i livelli della lipoproteina(a) o Lp(a), un altro importante fattore di rischio coronarico.
E tuttavia nel 2004 studi prospettici hanno dimostrato che la relazione tra l’assunzione di grassi trans e l’incidenza di CHD è maggiore di quella prevista da cambiamenti nei livelli dei lipidi sierici da soli. Ciò suggerisce che tali acido grassi influenzino altri fattori di rischio per la CHD, come l’infiammazione e la disfunzione delle cellule endoteliali.
Infiammazione e disfunzione delle cellule endoteliali
Il ruolo dell’infiammazione nell’aterosclerosi, e di conseguenza nella CHD, è cresciuto nell’ultimo decennio.
L’interleuchina-6, la proteina C-reattiva o CRP, acronimo dell’inglese C-reactive protein, e un’aumentata attività del fattore di necrosi tumorale o TNF, acronimo dell’inglese tumor necrosis factor, sono marcatori dell’infiammazione.
Nelle donne una maggiore assunzione di grassi trans è associata a un’aumentata attività del sistema TNF, e in quelle con un elevato indice di massa corporea con aumentati livelli di interleuchina-6 e CRP. Ad esempio, la differenza nei livelli di proteina C-reattiva osservata con un’assunzione media di grassi trans pari al 2,1% dell’assunzione di energia giornaliera totale, rispetto allo 0,9%, corrisponde a un aumento del rischio di malattia cardiovascolare del 30%. Risultati simili sono stati riportati in pazienti con malattia cardiaca, in studi randomizzati e controllati, in studi in vitro e in studi in cui sono stati analizzati i livelli di membrana degli acidi grassi trans, un biomarker della loro assunzione dietetica.
Quindi, i grassi trans promuovono l’infiammazione, e la loro azione pro-infiammatoria può spiegare parte dei loro effetti sulla CHD che, come visto, sono maggiori di quanto ci si aspetterebbe a seguito dei soli effetti sulle lipoproteine sieriche.
Attenzione: la presenza di infiammazione è un fattore di rischio indipendente non solo per la CHD ma anche per la resistenza all’insulina, il diabete, le dislipidemie e l’insufficienza cardiaca.
Un altro sito di azione degli acidi grassi trans può essere la funzione endoteliale. Diversi studi hanno suggerito l’associazione tra una loro maggiore assunzione e un aumento dei livelli dei biomarcatori circolanti della disfunzione endoteliale, come E-selectina, sICAM-1 e sVCAM-1.
Altri effetti
Studi in vitro hanno dimostrato che i grassi trans influenzano il metabolismo lipidico attraverso diversi percorsi.
- Alterano la secrezione, la composizione lipidica e le dimensioni dell’apolipoproteina B-100 o Apo B-100.
- Aumentano l’accumulo cellulare e la secrezione di colesterolo libero e di esteri del colesterolo da parte degli epatociti.
- Alterano, negli adipociti, l’espressione dei geni per il PPAR-gamma, acronimo dell’inglese peroxisome proliferator-activated receptor gamma, la lipoprotein lipasi e la resistina, proteine con un ruolo centrale nel metabolismo degli acidi grassi e del glucosio.
Cardiopatia coronarica
Gli acidi grassi trans sono un fattore di rischio cardiovascolare indipendente.
Dai primi anni ’90 del secolo scorso l’attenzione si è focalizzata sui loro effetti sui lipidi plasmatici e sulla concentrazione delle lipoproteine.
Dal punto di vista epidemiologico, quattro importanti studi prospettici, che hanno coinvolto circa 140.000 soggetti monitorati per 6-14 anni, hanno tutti trovato riscontri positivi tra i livelli di questi acidi grassi nella dieta, valutati con l’aiuto di un questionario dettagliato sulla composizione della dieta, e il rischio di CHD.
I quattro studi sono:
- The Health Professionals Follow-up study;
- The Alpha-Tocopherol Beta-Carotene Cancer Prevention Study;
- The Nurses’ Health Study;
- The Zutphen Elderly Study.
Questi studi riguardano popolazioni talmente diverse che molto probabilmente i risultati sono applicabili all’intera popolazione mondiale.
Una meta-analisi degli studi suddetti ha mostrato che un 2% di aumento nell’apporto energetico dai grassi trans era associato con un incremento del 23% nell’incidenza di cardiopatia coronarica. Il rischio relativo di malattia cardiaca era di 1,36 nel “The Health Professionals Follow-up Study”, 1,14 nel “The Alpha-Tocopherol Beta-Carotene Cancer Prevention Study”; 1,93 (1,43-2,61) nel “The Nurses’ Health Study” e 1,28 (1,01-1,61) nel “The Zutphen Elderly Study”.
Quindi, anche un piccolo incremento del loro consumo si associa a un sostanziale aumento del rischio: il 2% dell’apporto energetico giornaliero, per una dieta di 2000 Kcal corrisponde a 40 Kcal o 4-5 grammi di grasso cioè l’equivalente di un cucchiaino di grasso!
Inoltre, in tre di questi studi l’associazione tra l’assunzione di grassi trans e il rischio di cardiopatia coronarica era più forte di una corrispondente associazione con l’assunzione di acidi grassi saturi. Nel “The Zutphen Elderly Study” questa associazione non è stata indagata.
A causa degli effetti negativi degli acidi grassi trans, per gli autori della meta-analisi non è etico condurre studi clinici randomizzati a lungo termine per saggiarne gli effetti sull’incidenza della cardiopatia coronarica. Per questi autori “studi osservazionali eseguiti in modo accurato forniscono un approccio ragionevole per valutarne gli effetti sulla salute cardiovascolare”.
Quindi, per evitare i loro effetti nocivi, di gran lunga peggiori in media a quelli dovuti ai contaminanti alimentari o ai residui dei pesticidi, è necessario evitarli o limitarne il consumo a meno dello 0,5% dell’apporto energetico giornaliero.
Ulteriori prove
Uno studio condotto su una popolazione australiana con un primo attacco di cuore e nessuna precedente storia di cardiopatia coronarica o iperlipidemia ha evidenziato un’associazione positiva tra i livelli di acidi grassi trans nel tessuto adiposo e il rischio di un infarto miocardico non fatale.
E’ stato dimostrato che la presenza nel tessuto adiposo di un acido grasso trans 18:1 con il doppio legame in posizione 7 (C18:1Δ7t), che si ritrova sia nei grassi animali che vegetali, era un predittore indipendente di un primo infarto miocardico, ossia il suo livello nel tessuto adiposo rimane un fattore predittivo per la malattia cardiaca dopo aggiustamento per i livelli di colesterolo totale. Di nuovo, sembra che solo una minima parte degli effetti negativi di grassi trans si attui per mezzo delle lipoproteine plasmatiche.
Nel corso di questo studio, a metà del 1996, i grassi trans furono eliminati dalle margarine vendute in Australia. Questa è stata un’opportunità unica per studiare la relazione temporale tra la loro l’assunzione e i loro livelli nel tessuto adiposo. E’ stato dimostrato che scomparivano dal tessuto adiposo sia dei pazienti che dei controlli con un tasso di circa il 15% del totale degli acidi grassi trans/anno.
Un altro studio condotto in Costarica ha trovato un’associazione positiva tra infarto miocardico e acidi grassi trans .
E’ interessante notare che in uno studio più grande, basato su una comunità caso-controllo, i livelli degli acidi grassi trans nelle membrane dei globuli rossi sono stati associati, dopo correzione per gli altri fattori di rischio, con un aumento del rischio di morte cardiaca improvvisa. Inoltre, l’aumento del rischio sembra essere correlato ai livelli dei trans-C18:2, i cui livelli sono stati associati con una triplicazione del rischio di morte improvvisa per cause cardiache, ma non con i livelli nella membrana cellulare di trans-C18:1, la principale classe di isomeri degli acidi grassi trans presenti nei cibi.
Diabete
In uno studio prospettico che ha coinvolto 84.204 infermiere di età compresa tra i 34 e i 59 anni, senza nessuna storia pregressa di diabete, malattia cardiovascolare e cancro, analizzate tra il 1980 e il 1996, e appartenenti al “The Nurses’ Health Study”, l’apporto di acidi grassi trans era correlato in modo significativo con il rischio di sviluppare il diabete di tipo 2. Dopo aggiustamenti per altri fattori di rischio l’apporto di grassi trans era positivamente associato con l’incidenza del diabete, con un incremento del rischio superiore al 39%.
Dati da studi di intervento controllati hanno mostrato che gli acidi grassi trans potrebbero danneggiare la sensibilità all’insulina in soggetti con resistenza all’insulina e diabete di tipo 2 più di quanto facciano gli acidi grassi insaturi, in particolare gli isomeri dell’acido linoleico coniugato o CLA, acronimo dell’inglese conjugated linoleic acid, trans-10,cis-12-CLA.
Attenzione perché alcuni integratori contengono isomeri del CLA e possono essere diabetogeni e proaterogenici in soggetti con resistenza all’insulina.
Nota: anche gli acidi grassi saturi innescano la medesima risposta, con nessuna differenza significativa tra loro e gli acidi grassi trans).
Nessun effetto significativo riguardo alla sensibilità all’insulina è stato invece osservato in soggetti sani e magri.
Acidi grassi trans dai ruminanti e cardiopatia coronarica
Quattro studi prospettici hanno valutato la relazione tra l’assunzione di acidi grassi trans dai ruminanti e il rischio di CHD: non è stata identificata alcuna associazione significativa.
In un altro studio pubblicato nel 2008 sono stati analizzati i dati provenienti da quattro studi di coorte danesi, che coinvolgevano 3686 adulti, arruolati tra il 1974 e il 1993, e seguiti per una mediana di 18 anni. In Danimarca il consumo di prodotti lattiero-caseari è relativamente alto e l’intervallo di assunzione dei grassi trans che provengono dai ruminati piuttosto ampio, sino al 1,1% dell’energia. Negli altri paesi, per la maggior parte delle persone, il consumo di grassi trans dai ruminati è sostanzialmente più basso del 1% dell’energia; negli USA è circa lo 0,5%.
Dopo correzione per altri fattori di rischio, non è stata trovata alcuna significativa associazione tra il loro consumo e l’incidenza di CHD, confermando, in una popolazione con un’assunzione relativamente alta di questo tipo di acidi grassi, le conclusioni dei quattro precedenti studi prospettici.
Quindi gli acidi grassi trans dai ruminanti, nelle quantità effettivamente consumate nella dieta, non aumentano il rischio di cardiopatia coronarica.
L’assenza di rischio rispetto ai grassi trans industriali può essere dovuta alla minore assunzione. Basti considerare che per gli Statunitensi la maggior parte degli acidi grassi trans sono di origine industriale, e che i livelli di grassi trans nel latte e nella carne sono relativamente bassi, dall’1% all’8% del totale dei grassi.
L’assenza di un rischio più elevato di CHD può essere dovuta anche alla presenza di isomeri diversi. Gli acidi grassi trans dai ruminanti e quelli industriali condividono molti isomeri, ma ci sono alcune differenze quantitative:
- il livello di acido vaccenico è più alto nei grassi dei ruminanti, 30-50% degli isomeri trans-C18:1;
- il gruppo del trans-C18:2, presente negli oli fritti, deodorinizzati e in alcuni oli parzialmente idrogenati, non lo è in quantità apprezzabile nel grasso dei ruminanti.
Infine altri fattori, ancora non noti e potenzialmente protettivi, potrebbero superare gli effetti nocivi dovuti ai grassi trans dai ruminanti.
Acidi grassi trans: esempi di legislazione in diversi paesi
USA
Fino al 1985 non erano stati dimostrati effetti avversi dei grassi trans sulla salute umana e, addirittura, nel 1975 uno studio della Procter & Gamble non mostrò alcun effetto avverso sul colesterolo.
Il loro uso nei fast food crebbe dagli anni ’80, quando divenne chiaro il ruolo degli acidi grassi saturi nell’aumento del rischio cardiovascolare. Fu quindi condotta con successo una campagna per indurre la McDonald a passare dall’utilizzo del sego di bue a quello dell’olio vegetale per cucinare le patatine fritte. Nel frattempo diversi studi iniziarono a sollevare dubbi riguardo gli effetti dei grassi trans sulla salute.
La Food and Drug Administration, nel 1985, concluse che tali acidi grassi e l’acido oleico influenzavano il livello di colesterolo in maniera simile ma, dalla seconda metà del 1985 la pericolosità degli acidi grassi trans divenne chiara e la prova finale arrivò da studi di alimentazione controllata e da studi epidemiologici prospettici.
Nel 2003 la FDA ha stabilito che nei valori nutrizionali degli alimenti, sia per i cibi classici che per gli integratori, sia mostrato il loro contenuto a partire dal primo gennaio 2006. In particolare, questa ordinanza rappresenta il primo sostanziale cambiamento alla etichettatura dei prodotti alimentari dall’obbligo, risalente al 1990, di mettere le informazioni per porzione.
Nel 2005 il Dipartimento dell’Agricoltura statunitense ha fatto di un apporto minimo di grassi trans una raccomandazione chiave della nuova piramide alimentare.
Nel 2006 l’American Heart Association raccomanda di limitarne l’apporto all’1% del consumo calorico giornaliero e suggerisce ai produttori di alimenti e ai ristoranti di passare ad altri grassi.
Sempre nel 2006, il Dipartimento della Sanità della città di New York annuncia il divieto del loro utilizzo nei suoi 40.000 ristoranti entro il primo giugno 2008, seguito nel 2010-2011 dallo stato della California.
Australia
Dopo il giugno 1996 sono stati eliminati dalla margarina venduta in Australia, che in passato contribuiva per circa il 50% al loro apporto giornaliero in quel paese.
Europa
Dall’11 marzo 2003 il governo danese, dopo un dibattito iniziato nel 1994 e due nuovi rapporti nel 2001 e nel 2003, ha deciso di eliminarne gradualmente l’uso nei cibi prima della fine del 2003.
Due anni più tardi però, la Commissione Europea ha chiesto alla Danimarca di ritirare questa legge che, sfortunatamente, non è stata accettata a livello comunitario.
Tuttavia, nel 2007, la stessa Commissione Europea ha ritirato la procedura d’infrazione nei confronti della Danimarca grazie alle maggiori prove scientifiche sulla pericolosità di questo tipo di acidi grassi.
L’esempio danese è stato seguito nel 2009 dall’Austria e dalla Svizzera, nel 2011 dall’Islanda, dalla Norvegia e Ungheria nel 2014, e più di recente Estonia e Georgia. Quindi circa il 10% della popolazione della Comunità Europea, circa 500 milioni di persone, vive in paesi dove è illegale vendere prodotti con un elevato contenuto di grassi trans. I governi degli altri paesi della Comunità Europea fanno invece affidamento sulla volontà dei produttori di alimenti di ridurne il contenuto nei propri prodotti. Tale strategia si è dimostrata efficace solo nei paesi dell’Europa Occidentale.
Canada
Il Canada sta considerando la legislazione per eliminarli dalle forniture alimentari e nel 2005 ha introdotto l’obbligo di mostrare il loro contenuto negli alimenti preconfezionati.
In conclusione, con l’eccezione di pochi paesi nei quali l’uso a scopi alimentari dei grassi trans è stato vietato, negli altri l’unico modo per ridurne l’apporto è la scelta del consumatore di preferire cibi in cui non siano presenti, leggendo sempre gli ingredienti, anche nel caso in cui il loro contenuto sulla confezione sia dichiarato pari a 0, potendo provenire dalla margarina, dai grassi vegetali per pasticceria, dall’olio vegetale e dalla frittura. Infatti ad esempio negli USA, i produttori di alimenti che ne contengano meno di 0,5 g per porzione possono dichiararne sulla confezione un contenuto pari a 0. Questo contenuto è basso, ma se un consumatore mangia più porzioni, ne consuma quantità sostanziali.
Attenzione: la lista degli ingredienti non è obbligatoria nei ristoranti, forni e in molti altri esercizi alimentari al dettaglio.
Riformulazione degli alimenti per ridurre gli acidi grassi trans
Le organizzazioni di sanità pubblica, compresa l’Organizzazione Mondiale della Sanità a partire dal settembre del 2006, hanno raccomandato di ridurre il consumo di acidi grassi trans. Solo negli USA la loro quasi eliminazione potrebbe evitare tra i 72.000 e i 280.000 casi di malattie cardiovascolari degli 1,2 milioni che si verificano annualmente.
I produttori di alimenti e i ristoranti possono ridurre l’uso dei grassi trans scegliendo alternative agli oli parzialmente idrogenati.
In Danimarca la loro eliminazione dagli oli vegetali non ha aumentato il consumo dei grassi saturi in quanto sono stati per lo più sostituiti con acidi grassi cis-insaturi. Inoltre, non ci sono stati effetti evidenti per i consumatori: ne aumenti nei costi ne riduzioni della disponibilità e della qualità dei prodotti alimentari.
Nel 2009, Stender e colleghi, analizzando ciò che è accaduto negli USA, in Sud Africa e molte nazioni europee, hanno dimostrato che gli acidi grassi trans in alimenti come patatine fritte, biscotti, torte e pop corn per il microonde possono essere sostituiti, a un prezzo simile, con una miscela di acidi grassi saturi, monoinsaturi e polinsaturi. Una tale sostituzione assicura anche maggiori benefici nutrizionali rispetto a quella uno a uno tra i grassi trans e i grassi saturi da soli.
Tuttavia attenzione perché ad esempio solamente nelle patatine fritte con bassi livelli di grassi trans la percentuale di acidi grassi saturi rimane costante, mentre nei biscotti e nelle torte è in media del 33% maggiore e nei pop corn per forno a microonde del 24%: gli acidi grassi saturi sono si meno pericolosi degli grassi trans ma di più rispetto agli acidi grassi mono- e polinsaturi.
Lo stesso gruppo di ricerca, analizzando alcuni cibi di comune consumo in Europa, acquistati in supermercati, anche della stessa catena, e in fast food (McDonald’s e Kentucky Fried Chicken, KFC) dal 2005 al 2014, ha dimostrato come il loro contenuto in grassi trans sia ridotto o addirittura assente in diversi paesi dell’Europa Occidentale mentre rimanga ancora alto in paesi dell’Europa dell’Est e del Sud-Est.
Nel 2010 Mozaffarian e colleghi hanno valutato i livelli degli acidi grassi trans e dei grassi saturi nei cibi dei principali supermercati di marca statunitensi e dei ristoranti dopo la riformulazione per ridurre il contenuto dei primi in due momenti: dal 1993 sino al 2006 e dal 2006 al 2009. E’ stata rilevata una generale riduzione del loro contenuto senza alcun sostanziale od equivalente aumento nel contenuto degli acidi grassi saturi.
Fonti alimentari
Nel mondo sono molti gli alimenti ricchi di grassi trans comunemente consumati.
Negli USA gran parte proviene da oli vegetali parzialmente idrogenati, con un consumo medio da questa fonte che è rimasto costante dagli anni ’60 dello scorso secolo.
Da notare che i valori degli acidi grassi trans che si incontreranno devono essere interpretati con cautela perché molti fast food, ristoranti e industrie possono aver cambiato il tipo di grasso utilizzato per la frittura e la cottura da quando gli articoli analizzati sono stati pubblicati.
I valori riportati, se non diversamente specificato, si riferiscono al contenuto percentuale in acidi grassi trans/100 g di acidi grassi.
Margarina
Tra gli alimenti ricchi di grassi trans la margarina, in bastoncini o dura, ne ha avuto la percentuale più alta. Tuttavia, i loro livelli hanno iniziato a ridursi quando il miglioramento della tecnologia ha permesso la produzione di margarine più morbide, che nel tempo sono divenute popolari. Esistono comunque differenze nel contenuto di grassi trans di margarine provenienti da diversi paesi. Di seguito alcuni esempi.
- Il contenuto più alto, 13-16,5%, si ritrova nelle margarine morbide provenienti dall’Islanda, Norvegia e Regno Unito.
- Un contenuto minore è presente in quelle dall’Italia, Germania, Finlandia e Grecia, rispettivamente il 5,1%, 4,8%, 3,2%, e 2,9%.
- In Portogallo, Paesi Bassi, Belgio, Danimarca, Francia, Spagna e Svezia il contenuto è inferiore al 2%.
USA e Canada sono in ritardo rispetto all’Europa, ma negli USA sono in corso dei cambiamenti a seguito dell’introduzione dei grassi trans nell’etichettatura degli alimenti e della maggior conoscenza dei pericoli associati al loro consumo da parte degli acquirenti. Per questo motivo, al momento, negli USA la margarina è considerata contribuire in misura minore al totale dei grassi trans, mentre le fonti principali sono i prodotti commerciali da forno e dei fast food, come torte, biscotti, wafer, cracker, crocchette di pollo, patatine fritte o pop corn per il forno a microonde (vedi sotto).
Grassi da pasticceria
Il contenuto in grassi trans dei grassi da pasticceria è compreso tra il 6% e il 50%, e varia nei diversi paesi: in Germania, Austria e Nuova Zelanda è più basso che in Francia o negli USA.
Tuttavia, come per la margarina, anche per i grassi da pasticceria il loro contenuto è in diminuzione. In Germania è calato dal 12% nel 1994 al 6% nel 1999, in Danimarca è il 7% (1996), mentre in Nuova Zelanda è di circa il 6% (1997).
Oli vegetali
Al momento gli oli vegetali non idrogenati utilizzati per condire le insalate o per cucinare non contengono acidi grassi trans o ne contengono solo piccole quantità.
La lavorazione di questi oli può comportarne la produzione di piccole quantità, variabili da 0,05 g/100 g di prodotto per l’olio di oliva extra-vergine a 2,42 g/100 g di prodotto per l’olio di colza. Quindi il loro contributo al contenuto di grassi trans dei cibi attualmente consumati è molto piccolo.
Un’eccezione è rappresentata dagli oli vegetali idrogenati pachistani, che ne possono contenere dal 14% al 34%.
Minestre pronte
Tra gli alimenti ricchi di grassi trans le minestre pronte ne contengono quantità significative, che variano dal 10% del brodo di manzo al 35% della crema di cipolle; quindi, se consumate di frequente contribuiscono in grande misura all’apporto di tali acidi grassi nella dieta.
Prodotti alimentari trasformati
Gli acidi grassi trans, grazie alle loro proprietà sono utilizzati nella preparazione di molti alimenti trasformati come biscotti, torte, cornetti, dolci e altri prodotti da forno. E, nella dieta consumata in Nord America, i prodotti da forno ne sono la principale fonte.
Naturalmente, il contenuto in grassi trans dipende dal tipo di grassi utilizzati nella lavorazione.
Salse
La maionese, i condimenti per le insalate e altre salse apportano quantità di grassi trans piccole o nulle.
Latte umano e alimenti per neonati
Il contenuto di acidi grassi trans del latte umano riflette il contenuto in tali grassi della dieta materna nel giorno precedente, è compreso tra 1% e il 7% ed è in diminuzione dal 7,1% del 1998 al 4,6% del biennio 2005-2006.
Gli alimenti per lattanti hanno valori di grassi trans in media di 0,1%-4,5%, con una marca che raggiunge il 15,7%.
Gli alimenti per bambini ne contengono più del 5%.
Fast food e ristoranti
Nei fast food e ristoranti, per la frittura, vengono utilizzati grassi usati anche in pasticceria, quindi con elevate quantità di acidi grassi trans; pertanto i cibi venduti possono contenerne quantità relativamente alte. Fonti sono le torte fritte, le patatine fritte, le crocchette di pollo, gli hamburger, le fritture di pesce e il pollo fritto.
In lavori pubblicati da Stender e colleghi dal 2006 al 2009 viene dimostrato che il contenuto di grassi trans delle patatine fritte e delle crocchette di pollo variava ampiamente da paese a paese ma, anche all’interno della stessa catena di fast food, in uno stesso paese, e addirittura in una stessa città, a causa dell’olio utilizzato per cucinare. Ad esempio, l’olio utilizzato per le patatine fritte nei punti vendita di McDonald’s negli USA e in Perù ne conteneva il 23-24%, mentre l’olio utilizzato nella stessa catena in molti paesi europei ne contiene circa il 10%, con alcuni paesi, come la Danimarca, a un livello più basso del 5% e 1%.
E, considerando un pasto a base di patatine fritte e crocchette di pollo, in porzioni rispettivamente da 171 e 160 g, acquistato da McDonald a New York, lo stesso conteneva oltre 10 g di grassi trans mentre, se veniva acquistato da KFC in Ungheria si arrivava a quasi a 25 g.
Di seguito, sempre dai lavori di Stender e colleghi, si può osservare una comparazione tra diversi paesi per quanto riguarda il contenuto di grassi trans delle crocchette di pollo e delle patatine fritte acquistate da McDonald o da KFC.
Crocchette di pollo e patatine fritte da McDonald:
- meno di un grammo solo se i pasti sono stati acquistati in Danimarca;
- 1-5 g in Portogallo, Paesi Bassi, Russia, Repubblica Ceca o Spagna;
- 5-10 g negli USA, Perù, Regno Unito, Sud Africa, Polonia, Finlandia, Francia, Italia, Norvegia, Spagna, Svezia, Germania o Ungheria.
Crocchette di pollo e patatine fritte da KFC:
- meno di 2 g se i pasti sono stati acquistati nel Regno Unito, Danimarca, Russia o Germania;
- 2-5 g in Germania, Francia, Regno unito, Spagna o Portogallo;
- 5-10 g alle Bahamas, Sud Africa o USA;
- 10-25 g in Ungheria, Polonia, Perù o Repubblica Ceca.
Bibliografia
- Akoh C.C. and Min D.B. Food lipids: chemistry, nutrition, and biotechnology. 3rd Edition. CRC Press Taylor & Francis Group, 2008
- Ascherio A., Katan M.B., Zock P.L., Stampfer M.J., Willett W.C. Trans fatty acids and coronary heart disease. N Engl J Med 1999;340:1994-1998. doi:10.1056/NEJM199906243402511
- Ascherio A., Rimm E.B., Giovannucci E.L., Spiegelman D., Stampfer M., Willett W.C. Dietary fat and risk of coronary heart disease in men: cohort follow up study in the United States. BMJ 1996; 313:84-90. doi:10.1080/17482970601069094
- Asp N-G. Fatty acids in focus – the good and the bad ones. Scand J Food Nutr 2006;50:155-160. doi:10.1080/17482970601069094
- Baylin A., Kabagambe E.K., Ascherio A., Spiegelman D., Campos H. High 18:2 trans-fatty acids in adipose tissue are associated with increased risk of nonfatal acute myocardial infarction in Costa Rican adults. J Nutr 2003;133:1186-1191. doi:10.1093/jn/133.4.1186
- Chow C.K. Fatty acids in foods and their health implication. 3rd Edition. CRC Press Taylor & Francis Group, 2008.
- Clifton P.M., Keogh J.B., Noakes M. Trans fatty acids in adipose tissue and the food supply are associated with myocardial infarction. J Nutr 2004;134:874-879. doi:10.1093/jn/134.4.874
- Costa N., Cruz R., Graça P., Breda J., and Casal S. Trans fatty acids in the Portuguese food market. Food Control 2016;64:128-134. doi:10.1016/j.foodcont.2015.12.010
- Eckel R.H., Borra S., Lichtenstein A.H., Yin-Piazza D.Y. Understanding the Complexity of Trans fatty acid reduction in the American diet. American Heart Association trans fat conference 2006 report of the trans fat conference planning group. Circulation 2007;115:2231-2246. doi:10.1161/CIRCULATIONAHA.106.181947
- Hu F.B., Manson J.E., Stampfer M.J., Colditz G., Liu S., Solomon C.G., and Willett W.C. Diet, lifestyle, and the risk of type 2 diabetes mellitus in women. N Engl J Med 2001;345:790-797. doi:10.1056/NEJMoa010492
- Hu F.B., Willett W.C. Optimal diet for prevention of coronary heart disease JAMA 2002;288:2569-2578. doi:10.1001/jama.288.20.2569
- Lemaitre R.N., King I.B., Raghunathan T.E., Pearce R.M., Weinmann S., Knopp R.H., Copass M.K., Cobb L.A., Siscovick D.S. Cell membrane trans-fatty acids and the risk of primary cardiac arrest. Circulation 2002;105:697-701. doi:10.1161/hc0602.103583
- Lemaitre R.N, King I.B, Mozaffarian D., Sootodehnia N., Siscovick D.S. Trans-fatty acids and sudden cardiac death. Atheroscler Suppl 2006; 7(2):13-5. doi:10.1016/j.atherosclerosissup.2006.04.003
- Lichtenstein A.H. Dietary fat, carbohydrate, and protein: effects on plasma lipoprotein patterns J. Lipid Res. 2006;47:1661-1667. doi:10.1194/jlr.R600019-JLR200
- Lichtenstein A.H., Ausman L., Jalbert S.M., Schaefer E.J. Effect of different forms of dietary hydrogenated fats on serum lipoprotein cholesterol levels. N Engl J Med 1999;340:1933-1940. doi:10.1056/NEJM199906243402501
- Lopez-Garcia E., Schulze M.B., Meigs J.B., Manson J.E, Rifai N., Stampfer M.J., Willett W.C. and Hu F.B. Consumption of trans fatty acids is related to plasma biomarkers of inflammation and endothelial dysfunction. J Nutr 2005;135:562-566. doi:10.1093/jn/135.3.562
- Masanori S. Trans Fatty Acids: Properties, Benefits and Risks J Health Sci 2002;48(1):7-13.
- Mensink R.P., Katan M.B. Effect of dietary trans fatty acids on high-density and low-density lipoprotein cholesterol levels in healthy subjects. N Engl J Med 1990;323:439-445. doi:10.1056/NEJM199008163230703
- Mozaffarian D. Commentary: Ruminant trans fatty acids and coronary heart disease-cause for concern? Int J Epidemiol 2008;37(1):182-184. doi:10.1093/ije/dym263
- Mozaffarian D., Jacobson M.F., Greenstein J.S. Food Reformulations to reduce trans fatty acids. N Eng J Med 2010;362:2037-2039. doi:https://doi.org/10.1056/NEJMc1001841
- Mozaffarian D., Katan M.B., Ascherio A., Stampfer M.J., Willett W.C. Trans fatty acids and cardiovascular disease. N Engl J Med 2006;354:1601-1613. doi:10.1056/NEJMra054035
- Mozaffarian D., Pischon T., Hankinson S.E., Joshipura K., Willett W.C., and Rimm E.B. Dietary intake of trans fatty acids and systemic inflammation in women. Am J Clin Nutr 2004;79:606-612. doi:https://doi.org/10.1093/ajcn/79.4.606
- Oh K., Hu F.B., Manson J.E., Stampfer M.J., Willett W.C. Dietary fat intake and risk of coronary heart disease in women: 20 years of follow-up of the Nurses’ Health Study. Am J Epidemiol 2005;161(7):672-679. doi:10.1093/aje/kwi085
- Okie S. New York to Trans Fats: You’re Out! N Engl J Med 2007;356:2017-2021. doi:10.1056/NEJMp078058
- Oomen C.M., Ocke M.C., Feskens E.J., van Erp-Baart M.A., Kok F.J., Kromhout D. Association between trans fatty acid intake and 10-year risk of coronary heart disease in the Zutphen Elderly Study: a prospective population-based study. Lancet 2001; 357(9258):746-751. doi:10.1016/S0140-6736(00)04166-0
- Pietinen P., Ascherio A., Korhonen P., Hartman A.M., Willett W.C., Albanes D., VirtamO J.. Intake of fatty acids and risk of coronary heart disease in a cohort of Finnish men: the Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study. Am J Epidemiol 1997;145(10):876-887. doi:10.1093/oxfordjournals.aje.a009047
- Risérus U. Trans fatty acids, insulin sensitivity and type 2 diabetes. Scand J Food Nutr 2006;50(4):161-165. doi:10.1080/17482970601133114
- Salmerón J., Hu F.B., Manson J.E., Stampfer M.J., Colditz G.A., Rimm E.B., and Willett W.C. Dietary fat intake and risk of type 2 diabetes in women. Am J Clin Nutr 2001;73:1019-1026 doi:10.1093/ajcn/73.6.1019
- Stender S., Astrup A., and Dyerberg J. A trans European Union difference in the decline in trans fatty acids in popular foods: a market basket investigation. BMJ Open 2012;2(5):e000859. doi:10.1136/bmjopen-2012-000859
- Stender S., Astrup A., and Dyerberg J. Artificial trans fat in popular foods in 2012 and in 2014: a market basket investigation in six European countries. BMJ Open 2016;6(3):e010673. doi:10.1136/bmjopen-2015-010673
- Stender S., Astrup A.,and Dyerberg J. Tracing artificial trans fat in popular foods in Europe: a market basket investigation. BMJ Open 2014;4(5):e005218. doi:10.1136/bmjopen-2014-005218
- Stender S., Astrup A., Dyerberg J. What went in when trans went out?. N Engl J Med 2009;361:314-316. doi:10.1056/NEJMc0903380
- Stender S., Dyerberg J. The influence of trans fatty acids on health. Fourth edition. The Danish Nutrition Council; publ. no. 34, 2003.
- Stender S., Dyerberg J., Astrup A. Consumer protection through a legislative ban on industrially produced trans fatty acids in Denmark. Scand J Food Nutr 2006;50(4):155-160. doi:10.1080/17482970601069458
- Stender S., Dyerberg J., Astrup A. High levels of trans fat in popular fast foods. N Engl J Med 2006;354:1650-1652. doi:10.1056/NEJMc052959
- Willett W., Mozaffarian D. Ruminant or industrial sources of trans fatty acids: public health issue or food label skirmish? Am J Clin Nutr 2008;87(3): 515-516. doi:10.1093/ajcn/87.3.515