Il maltosio, anche detto zucchero di malto o α-D-glucopiranosil-(1→4)-D-glucopiranosio, è un disaccaride formato da due molecole di D-glucosio in forma piranosica. I due monosaccaridi sono uniti da un legame glicosidico α-(1→4), un legame covalente tra il C1 di una molecola di glucosio, ossia il suo carbonio anomerico emiacetalico, e l’atomo di ossigeno del gruppo ossidrilico sul C4 dell’altra molecola di glucosio. Il legame glicosidico si verifica con ritenzione della configurazione sul C1, che rimane quindi in configurazione α. Poiché uno dei residui di glucosio conserva un carbonio emiacetalico, il maltosio è uno zucchero riducente.[1][2]
Il maltosio è prodotto nella porzione prossimale dell’intestino tenue, il duodeno, e nei semi in germinazione, dall’azione delle amilasi sull’amido.[3]
A livello industriale, deriva dall’idrolisi sia acida che enzimatica di amidi di diverse origini. Per l’idrolisi enzimatica sono utilizzate amilasi sia fungine, ad esempio derivanti da Aspergillus oryzae, che batteriche, come quelle di Bacillus subtilis.[4][5]
Il maltosio non è presente naturalmente nei cibi; si trova solo in alcuni alimenti lavorati ai quali viene aggiunto durante la produzione.[6] Ad esempio, è presente in molti prodotti da forno e di pasticceria, dove vengono sfruttate le sue capacità di agire come dolcificante, stabilizzante e conservante.[7] Pertanto, può essere annoverato tra gli additivi a uso alimentare consentiti dalle normative vigenti.[8]
Nel duodeno, grazie alla presenza di specifiche idrolasi nell’orletto a spazzola degli enterociti, il legame glicosidico α-(1→4) viene idrolizzato. Il glucosio prodotto è quindi assorbito e passa nel circolo ematico.[9]
Indice
- Proprietà chimiche
- Funzioni
- Digestione intestinale
- Deficit della saccarasi-isomaltasi e maltasi-glucoamilasi
- Bibliografia
Proprietà chimiche
Come i disaccaridi lattosio, saccarosio e trealosio, ha formula molecolare C12H22O11 e massa molare di 342,30 g/mol.[10]
È molto solubile in acqua e la sua dolcezza è pari a circa il 33% di quella del saccarosio.[11]
Al pari dei monosaccaridi, e del lattosio tra i disaccaridi, è uno zucchero riducente, in quanto il legame glicosidico α-(1→4) non interessa il carbonio emiacetalico (anomerico) di uno dei due residui di glucosio. Questo carbonio è quindi libero di tornare alla forma carbonilica; in soluzione, l’anello può aprirsi esponendo un gruppo aldeidico libero. Va comunque sottolineato che la forma a catena aperta è presente in quantità molto piccole.[2]
Il carbonio anomerico non coinvolto nel legame glicosidico presenta mutarotazione, sono cioè permesse entrambe le configurazioni α e β, sebbene la configurazione β sia la forma predominante.
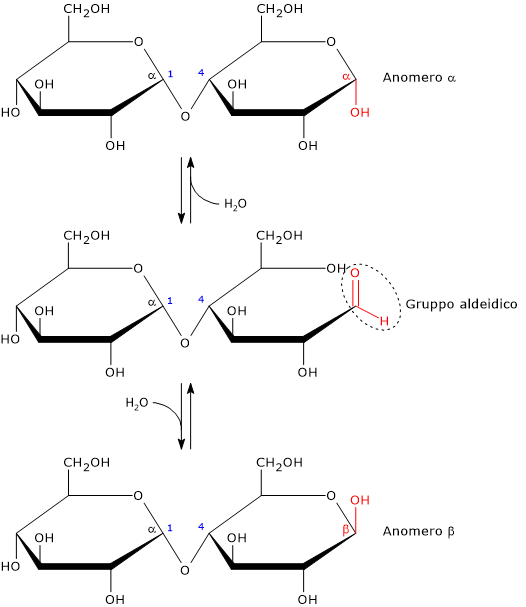
L’anomeria è un tipo di isomeria ottica caratteristica dei carboidrati. Due stereoisomeri di un monosaccaride ciclico sono definiti anomeri se differiscono solo per la configurazione del carbonio emiacetale o emichetale, che è chiamato carbonio anomerico o centro anomerico.[1]
Quello che accade è che la ciclizzazione intramolecolare dei monosaccaridi fa sì che l’atomo di carbonio del gruppo carbonile diventi un carbonio asimmetrico, ovvero un centro di chiralità. E in soluzione, in equilibrio con la forma aperta, si possono formare due anomeri:
- l’isomero α, se, durante la ciclizzazione, l’ossigeno del gruppo ossidrile attacca l’atomo di carbonio del gruppo carbonilico dall’alto rispetto al piano sp2;
- l’isomero β, se l’ossigeno del gruppo ossidrile attacca l’atomo di carbonio del gruppo carbonilico dal basso rispetto al piano sp2.[12]
Funzioni
Durante la germinazione dei semi, l’amido presente nell’endosperma viene idrolizzato a dare maltosio e glucosio, zuccheri che andranno a supportare, assieme ad altri prodotti di idrolisi, la crescita della piantina in germinazione.[13]
La produzione di bevande alcoliche derivanti dalla fermentazione dei cereali, la panificazione, la produzione di preparati ad alto contenuto di maltosio, come gli sciroppi di glucosio e maltosio, sfruttano anch’essi l’azione delle amilasi sugli amidi per il rilascio del disaccaride.[3][14]
In pasticceria, il maltosio viene utilizzato sia come dolcificante che stabilizzante per glasse, di cui non aumenta la dolcezza come invece farebbe il saccarosio. Inoltre, essendo in grado di inibire la retrogradazione dell’amido, può prolungarne la durata di conservazione.[7] Per questi motivi, il maltosio può essere annoverato sia tra i conservanti, i dolcificanti e gli stabilizzanti a uso alimentare. È presente anche in molte preparazioni a base di carboidrati per l’alimentazione infantile.[8]
Al di fuori dell’industria alimentare, è utilizzato ad esempio come stabilizzante per le immunoglobuline.[10][15]
Digestione intestinale
Nell’uomo, la digestione dei carboidrati ha inizio nel cavo orale, per azione della alfa-amilasi salivare per poi proseguire e terminare nel duodeno, grazie a specifiche idrolasi quali la α-amilasi pancreatica e le idrolasi dell’orletto a spazzola degli enterociti. L’azione combinata di questi enzimi permette l’idrolisi dei disaccaridi, oligosaccaridi e polisaccaridi nei monosaccaridi costituenti, ovvero fruttosio, glucosio, galattosio. Sempre nell’intestino tenue si verifica l’assorbimento dei monosaccaridi rilasciati, assorbimento mediato da specifici trasportatori proteici presenti nella membrana plasmatica dell’enterocita.[9]
L’azione della α-amilasi salivare e pancreatica sui due polisaccaridi componenti l’amido, amilosio e amilopectina, porta al rilascio di maltosio, maltotriosio, un oligosaccaride formato da tre molecole di glucosio unite da legami glicosidici α-(1→4), e, dall’amilopectina, anche di destrine α-limite, che sono polimeri di glucosio dove è presente almeno un legame glicosidico α-(1→6).[16][17]
Sebbene dalla digestione del glicogeno si possano ottenere maltosio, maltotriosio e destrine α-limite, il suo ruolo è trascurabile in quanto, dopo la morte dell’animale, va incontro a una rapida degradazione, per la maggior parte a glucosio e acido lattico.[18]
Il legame glicosidico α-(1→4) del maltosio è idrolizzato in una reazione che può essere catalizzata da due enzimi: la saccarasi-isomaltasi (EC 3.2.1.48 e 3.2.1.10) e la maltasi-glucoamilasi o MAG (EC 3.2.1.20).[2]
Saccarasi-isomaltasi
La saccarasi-isomaltasi è un enzima bifunzionale che presenta due siti attivi.[19][20] Un sito attivo, la saccarasi, è una α-glicosidasi che idrolizza i legami glicosidici del maltosio, saccarosio, e di piccoli oligomeri di glucosio α-(1→4) legati e formati da un massimo di sei unità glucosidiche.[21] La saccarasi è responsabile di circa il 60−80% dell’attività maltasica presente nell’intestino tenue.[22] L’altro sito attivo, la isomaltasi o α-destrinasi, è una α-(1→6) glicosidasi che idrolizza i legami glicosidici α-(1→6) nelle destrine α-limite.[23]
Maltasi-glucoamilasi
Al pari della saccarasi-isomaltasi, la maltasi-glucoamilasi presenta due siti attivi, uno più specifico per il maltosio, e l’altro con una più ampia specificità di substrato, in grado di agire sugli oligomeri del glucosio. Entrambi i siti attivi catalizzano il rilascio di unità di glucosio.[24][25][26]
Si noti che l’azione sinergica della α-amilasi, della sucrasi-isomaltasi e della maltasi-glucoamilasi è in grado di digerire completamente l’amido in unità di glucosio.[9][17]
Deficit della saccarasi-isomaltasi e maltasi-glucoamilasi
Il deficit a carico di una delle glicosidasi dell’orletto a spazzola degli enterociti è in genere conseguenza di un difetto genetico, mentre possono essere tutte assenti a seguito di una infezione intestinale, risolta la quale gradualmente si torna alla normalità.[27]
Nel deficit congenito o primario della saccarasi-isomaltasi può essere interessata sia la saccarasi che l’isomaltasi, con accumulo, nel primo caso anche di maltosio.[28] Analoga situazione si può presentare nel deficit congenito di maltasi-glucoamilasi, una condizione piuttosto rara, di cui sono stati descritti pochi casi in letteratura.[29]
In entrambi i casi, come anche a seguito di una infezione intestinale, i carboidrati non digeriti rimangono nel lume intestinale, dove poi possono essere in parte fermentati dai batteri del microbiota intestinale, che è parte del microbiota umano, a dare un eccesso di gas, come idrogeno, metano, e anidride carbonica, e acidi grassi a catena corta, quali l’acido acetico, l’acido propionico e l’acido butirrico.[30][31] La presenza di carboidrati non digeriti e dei prodotti della loro fermentazione, molti dei quali sono soluti osmoticamente attivi, provoca un aumento della pressione osmotica intraluminale, un afflusso di acqua nel lume e successiva diarrea.[32]
Il trattamento consiste nel ridurre o eliminare il maltosio dalla dieta.[33]
Bibliografia
- ^ a b Soderberg T. Organic chemistry with a biological emphasis. Volume II. Chemistry Publications. 2019. https://digitalcommons.morris.umn.edu/chem_facpubs/2
- ^ a b c Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 8th Edition. W.H. Freeman and Company, 2021.
- ^ a b Garrett R.H., Grisham C.M. Biochemistry. 6th Edition. Brooks/Cole, Cengage Learning, 2016.
- ^ Benjamin S., Smitha R.B., Jisha V.N., Pradeep S., Sajith S., Sreedevi S., Priji P., Unni K.N., Sarath Josh M.K. A monograph on amylases from Bacillus spp. Adv biosci biotechnol 2013;4(2):227-241. doi:10.4236/abb.2013.42032
- ^ Gopinath S.C., Anbu P., Arshad M.K., Lakshmipriya T., Voon C.H., Hashim U., Chinni S.V. Biotechnological processes in microbial amylase production. Biomed Res Int 2017;2017:1272193. doi:10.1155/2017/1272193
- ^ Crow R.R., Kumar S., Varela M.F. Maltose chemistry and biochemistry. In: Preedy V.R. editor. Dietary sugars: chemistry, analysis, function and effects. Cambridge: Royal Society of Chemistry; 2012. p. 101-114. doi:10.1039/9781849734929-00101
- ^ a b Wang S., Li C., Copeland L., Niu Q., Wang S. Starch Retrogradation: a comprehensive review. Compr Rev Food Sci Food Saf 2015;14:568-585. doi:10.1111/1541-4337.12143
- ^ a b EFSA. Food additives. Last reviewed date: 13 November 2025.
- ^ a b c Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 4th Edition. St. Louis: Elsevier, 2018.
- ^ a b National Center for Biotechnology Information. PubChem Compound Summary for CID 439186, Maltose. https://pubchem.ncbi.nlm.nih.gov/compound/Maltose. Accessed Nov. 19, 2025.
- ^ Spillane W.J. Optimising sweet taste in foods. Woodhead Publishing; 2006. p. 271.
- ^ Solomons T.W.G., Fryhle C.B., Snyder S.A. Solomons’ organic chemistry. 12th Edition. John Wiley & Sons Incorporated, 2017.
- ^ Andriotis V.M., Saalbach G., Waugh R., Field R.A., Smith A.M. The maltase involved in starch metabolism in barley endosperm is encoded by a single gene. PLoS One 2016;11(3):e0151642. doi:10.1371/journal.pone.0151642
- ^ Cauvain S.P, Young L.S. Technology of breadmaking. 2nd Edition. New York: Springer; 2007.
- ^ Alder L.B., Morgan L.A., Spickett G.P. Contribution of stabilizing agents present in intravenous immunoglobulin preparations to modulation of mononuclear cell proliferation in vitro. Scand J Immunol 1996;44(6):585-91. doi:10.1046/j.1365-3083.1996.d01-350.x
- ^ Butterworth P.J., Warren F.J. and Ellis P.R. Human α-amylase and starch digestion: an interesting marriage. Starch/Stärke 2011;63:395-405. doi:10.1002/star.201000150
- ^ a b Gangoiti J., Corwin S.F., Lamothe L.M., Vafiadi C., Hamaker B.R., Dijkhuizen L. Synthesis of novel α-glucans with potential health benefits through controlled glucose release in the human gastrointestinal tract. Crit Rev Food Sci Nutr 2020;60(1):123-146. doi:10.1080/10408398.2018.1516621
- ^ Terlouw E.M.C., Picard B., Deiss V., Berri C., Hocquette J.F., Lebret B., Lefèvre F., Hamill R., Gagaoua M. Understanding the determination of meat quality using biochemical characteristics of the muscle: stress at slaughter and other missing keys. Foods 2021;10(1):84. doi:10.3390/foods10010084
- ^ Hauri H.P., Quaroni A., Isselbacher K.J. Biogenesis of intestinal plasma membrane: posttranslational route and cleavage of sucrase-isomaltase. Proc Natl Acad Sci U S A 1979;76(10):5183-6. doi:10.1073/pnas.76.10.5183
- ^ Hunziker W., Spiess M., Semenza G., Lodish H.F. The sucrase-isomaltase complex: primary structure, membrane-orientation, and evolution of a stalked, intrinsic brush border protein. Cell 1986;46(2):227-34. doi:10.1016/0092-8674(86)90739-7
- ^ Quezada-Calvillo R., Sim L., Ao Z., Hamaker B.R., Quaroni A., Brayer G.D., Sterchi E.E., Robayo-Torres C.C., Rose D.R., Nichols B.L. Luminal starch substrate “brake” on maltase-glucoamylase activity is located within the glucoamylase subunit. J Nutr 2008;138(4):685-92. doi:10.1093/jn/138.4.685
- ^ Gericke B., Schecker N., Amiri M., Naim H.Y. Structure-function analysis of human sucrase-isomaltase identifies key residues required for catalytic activity. J Biol Chem 2017;292(26):11070-11078. doi:10.1074/jbc.M117.791939
- ^ Quezada-Calvillo R., Robayo-Torres C.C., Ao Z., Hamaker B.R., Quaroni A., Brayer G.D., Sterchi E.E., Baker S.S., Nichols B.L. Luminal substrate “brake” on mucosal maltase-glucoamylase activity regulates total rate of starch digestion to glucose. J Pediatr Gastroenterol Nutr 2007 Jul;45(1):32-43. doi:10.1097/MPG.0b013e31804216fc
- ^ Nichols B.L., Eldering J., Avery S., Hahn D., Quaroni A., Sterchi E. Human small intestinal maltase-glucoamylase cDNA cloning. Homology to sucrase-isomaltase. J Biol Chem 1998;273(5):3076-81. doi:10.1074/jbc.273.5.3076
- ^ Sim L., Quezada-Calvillo R., Sterchi E.E., Nichols B.L., Rose D.R. Human intestinal maltase-glucoamylase: crystal structure of the N-terminal catalytic subunit and basis of inhibition and substrate specificity. J Mol Biol 2008;375(3):782-92. doi:10.1016/j.jmb.2007.10.069
- ^ Rose D.R., Chaudet M.M., Jones K. Structural studies of the Intestinal α-glucosidases, maltase-glucoamylase and sucrase-isomaltase. J Pediatr Gastroenterol Nutr 2018;66 Suppl 3:S11-S13. doi:10.1097/MPG.0000000000001953
- ^ Viswanathan L., Rao S.S. Intestinal disaccharidase deficiency in adults: evaluation and treatment. Curr Gastroenterol Rep 2023;25(6):134-139. doi:10.1007/s11894-023-00870-z
- ^ Senftleber N.K., Ramne S., Moltke I., Jørgensen M.E., Albrechtsen A., Hansen T., Andersen M.K. Genetic loss of sucrase-isomaltase function: mechanisms, implications, and future perspectives. Appl Clin Genet 2023;16:31-39. doi:10.2147/TACG.S401712
- ^ Nichols B.L., Avery S.E., Karnsakul W., Jahoor F., Sen P., Swallow D.M., Luginbuehl U., Hahn D., Sterchi E.E. Congenital maltase-glucoamylase deficiency associated with lactase and sucrase deficiencies. J Pediatr Gastroenterol Nutr 2002;35(4):573-9. doi:10.1002/j.1536-4801.2002.tb07889.x
- ^ Holtug K., Clausen M.R., Hove H., Christiansen J., Mortensen P.B. The colon in carbohydrate malabsorption: short-chain fatty acids, pH, and osmotic diarrhoea. Scand J Gastroenterol 1992;27(7):545-52. doi:10.3109/00365529209000118
- ^ Oliphant K., Allen-Vercoe E. Macronutrient metabolism by the human gut microbiome: major fermentation by-products and their impact on host health. Microbiome 2019;7(1):91. doi:10.1186/s40168-019-0704-8
- ^ Weijers H.A., va de Kamer J.H., Mossel D.A., Dicke W.K. Diarrhoea caused by deficiency of sugar-splitting enzymes. Lancet. 1960;2(7145):296-7. doi:10.1016/s0140-6736(60)91381-7
- ^ Gericke B., Amiri M., Naim H.Y. The multiple roles of sucrase-isomaltase in the intestinal physiology. Mol Cell Pediatr 2016;3(1):2. doi:10.1186/s40348-016-0033-y