L’amido sintasi (EC 2.4.1.21) è un enzima che catalizza il trasferimento di molecole di glucosio dall’ADP-glucosio all’estremità non riducente di un α-(1→4)-glucano preesistente, cui i monosaccaridi sono legati attraverso un legame glicosidico α-(1→4).[4]
[(1→4)-alfa-D-glucosil](n) + ADP-alfa-D-glucosio ⇌ [(1→4)-alfa-D-glucosil](n+1) + ADP + H(+)
L’enzima è coinvolto nella sintesi dell’amilosio e dell’amilopectina, i due polisaccaridi che costituiscono la quasi totalità del granulo di amido, la più abbondante forma di accumulo di carboidrati ed energia presente nelle piante.[7]
L’amido sintasi appartiene alla famiglia delle glicosiltransferasi (EC 2.4), al pari dell’amido fosforilasi (EC 2.4.1.1), un altro enzima coinvolto nel metabolismo dell’amido, e della glicogeno sintasi (EC 2.4.1.11) e glicogeno fosforilasi (EC 2.4.1.1), enzimi coinvolti rispettivamente nella sintesi del glicogeno e nella degradazione del glicogeno o glicogenolisi.[6] Tuttavia, mentre la glicogeno sintasi utilizza come donatore dell’unità glucosidica l’UDP-glucosio, e l’amido fosforilasi il glucosio-1-fosfato, l’amido sintasi utilizza l’ADP-glucosio.[2][3]
Indice
- Isoforme
- Amido sintasi e MOS
- Amido sintasi e sintesi dell’amilopectina
- GBSS e sintesi dell’amilosio
- Bibliografia
Isoforme
Nelle piante sono note sei isoforme di amido sintasi. Sono proteine strutturalmente correlate, cinque coinvolte nella sintesi dell’amilopectina, indicate come amido sintasi I, II, III, IV e V o, rispettivamente, SSI, SSII, SSIII, SSIV e SSV, e una coinvolta nella sintesi dell’amilosio, l’amido sintasi legata ai granuli o GBSS (EC 2.4.1.242).[6] GBSS, SSI, SSII, SSIII, e SSIV sono dotate di attività catalitica, mentre la SSV ne è priva.[1]
GBSS è quasi esclusivamente legata ai granuli, sembra per la maggior parte posizionata al suo interno, come evidenziato dal trattamento della superficie dei granuli con proteasi. Le altre isoforme dell’amido sintasi sono presenti o solamente nello stroma dei plastidi o suddivise tra stroma e granuli di amido, e sono dette solubili.[8]
Le amido sintasi I, II, III, e IV catalizzano l’aggiunta di una sola unità di glucosio per incontro con l’α-(1→4)-glucano nascente, modalità d’azione definita distributiva, mentre GBSS è in grado di catalizzare l’aggiunta di più unità glucosidiche per incontro con il substrato, modalità d’azione definita processuale.[11]
Amido sintasi e MOS
Le amido sintasi coinvolte nelle prime fasi della sintesi di amilosio e amilopectina necessitano della presenza di corti malto-oligosaccaridi o MOS per iniziare la sintesi de novo dei due polisaccaridi.[11]
Questi piccoli oligosaccaridi, ossia α-(1→4)-glucani lunghi da 2 a 7 residui glucosidici, fungono da primer e sono allungati, funzione analoga a quella svolta dalla glicogenina nella sintesi del glicogeno.
I MOS possono derivare dall’azione dell’amido sintasi III, dell’amido fosforilasi e degli enzimi deramificanti l’amido, in quest’ultimo caso nel corso del rifinitura di molecole di amilopectina.
Essendo scarsamente solubili, i MOS sembrano in grado di evitare l’azione idrolitica delle alfa-amilasi (EC 3.2.1.1) e delle beta-amilasi.[8]
Amido sintasi e sintesi dell’amilopectina
La sintesi dell’amilopectina richiede l’azione temporalmente coordinata di almeno quattro classi di enzimi, ossia gli isoenzimi dell’amido sintasi, l’amido fosforilasi, gli enzimi ramificanti l’amido (EC 2.4.1.18), e gli enzimi deramificanti l’amido.[2][7] Si ritiene inoltre che, in molti casi, questi enzimi interagiscono fisicamente tra loro a dare complessi multienzimatici, strutture in grado di aumentare l’efficienza di una via metabolica.[11]
E’ generalmente accettato che la crescita del granulo di amido avvenga a partire da una zona centrale detta ilo, la cui esatta struttura non è nota, sebbene sembra sia formata da una struttura relativamente disordinata di α-glucani.[13] L’iniziazione dell’ilo, la formazione di un granulo di amido strutturalmente normale, e il grado di accumulo dell’amido richiedono la presenza di SSIV, sebbene sia stato suggerito che anche SSIII e SSV possano svolgere un ruolo, sovrapponendo la loro azione con quella della SSIV.[10]
GBSS e sintesi dell’amilosio
La sintasi legata ai granuli è coinvolta nella sintesi dell’amilosio.
Questo enzima fu scoperto nei primi anni sessanta del secolo scorso dal gruppo di Luis Federico Leloir, lo stesso ricercatore che nel 1948 aveva scoperto la principale via per il metabolismo del galattosio, la via di Leloir.[5]
La sua azione catalitica non è del tutto contemporanea a quella delle altre amido sintasi in quanto necessita della presenza di un’impalcatura di amilopectina per essere indirizzata verso i granuli nascenti.[6]
Nelle Graminacee si conoscono due isoforme dell’enzima, codificate da geni distinti, e indicate come GBSSI e GBSSII.[12]
GBSS richiede, per la sua azione catalitica, la presenza di una proteina della famiglia PTST, la PTST1 che permette il suo legame al granulo di amido, e la cui azione sembra essere più importante nei cloroplasti rispetto agli amiloplasti.[9]
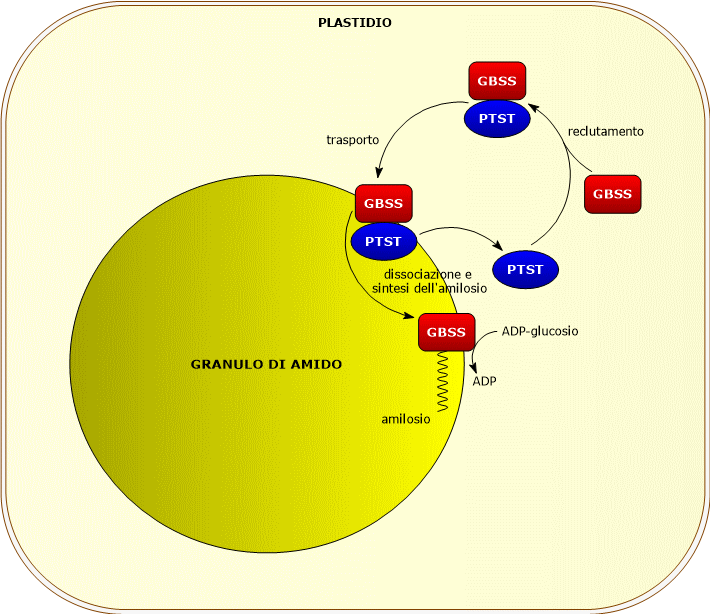
La proteina sembra si associ, nello stoma del plastidio, a GBSS. Il complesso formato si lega al granulo nascente, la proteina si dissocia dall’enzima che inizia a catalizzare l’allungamento dei malto-oligosaccaridi. PTST1 torna quindi nello stroma dove recluta un altro enzima.
Bibliografia
- ^ Abt M.R., Pfister B., Sharma M., Eicke S., Bürgy L., Neale I., Seung D., Zeeman S.C. STARCH SYNTHASE5, a noncanonical starch synthase-like protein, promotes starch granule initiation in Arabidopsis. Plant Cell 2020;32(8):2543-2565. doi:10.1105/tpc.19.00946
- ^ a b Crofts N., Abe N., Oitome N.F., Matsushima R., Hayashi M., Tetlow I.J., Emes M.J., Nakamura Y., Fujita N. Amylopectin biosynthetic enzymes from developing rice seed form enzymatically active protein complexes. J Exp Bot 2015;66(15):4469-82. doi:10.1093/jxb/erv212
- ^ Cuesta-Seijo J.A., Ruzanski C., Krucewicz K., Meier S., Hägglund P., Svensson B., Palcic M.M. Functional and structural characterization of plastidic starch phosphorylase during barley endosperm development. PLoS One 2017;12(4):e0175488. doi:10.1371/journal.pone
- ^ Gous P.W., Fox G.P. Review: Amylopectin synthesis and hydrolysis – Understanding isoamylase and limit dextrinase and their impact on starch structure on barley (Hordeum vulgare) quality. Trends Food Sci Technol 2017;62:23-32. doi:10.1016/j.tifs.2016.11.013
- ^ Leloir L.F., de Fekete M.A., Cardini C.E. Starch and oligosaccharide synthesis from uridine diphosphate glucose. J Biol Chem 1961;236:636-41. doi:10.1016/S0021-9258(18)64280-2
- ^ a b c Pfister B., Zeeman S.C. Formation of starch in plant cells. Cell Mol Life Sci 2016;73(14):2781-807. doi: 10.1007/s00018-016-2250-x
- ^ a b Qu J., Xu S., Zhang Z., Chen G., Zhong Y., Liu L., Zhang R., Xue J., Guo D. Evolutionary, structural and expression analysis of core genes involved in starch synthesis. Sci Rep 2018;8(1):12736. doi:10.1038/s41598-018-30411-y
- ^ a b Seung D., Boudet J., Monroe J., Schreier T.B., David L.C., Abt M., Lu K.J., Zanella M., Zeeman S.C. Homologs of PROTEIN TARGETING TO STARCH control starch granule initiation in Arabidopsis leaves. Plant Cell 2017;29(7):1657-1677. doi:10.1105/tpc.17.00222
- ^ Seung D., Soyk S., Coiro M., Maier B.A., Eicke S., and Zeeman S.C. PROTEIN TARGETING TO STARCH is required for localising GRANULE-BOUND STARCH SYNTHASE to starch granules and for normal amylose synthesis in Arabidopsis. PLoS Biol 2015;13:e1002080. doi:10.1371/journal.pbio.1002080
- ^ Szydlowski N., Ragel P., Raynaud S., Lucas M.M., Roldán I., Montero M., Muñoz F.J., Ovecka M., Bahaji A., Planchot V., Pozueta-Romero J., D’Hulst C., Mérida A. Starch granule initiation in Arabidopsis requires the presence of either class IV or class III starch synthases. Plant Cell 2009;21(8):2443-57. doi:10.1105/tpc.109.066522
- ^ a b c Tetlow I.J., Bertoft E. A review of starch biosynthesis in relation to the building block-backbone model. Int J Mol Sci 2020;21(19):7011. doi:10.3390/ijms21197011
- ^ Vrinten P.L., Nakamura T. Wheat granule-bound starch synthase I and II are encoded by separate genes that are expressed in different tissues. Plant Physiol 2000;122(1):255-64. doi:10.1104/pp.122.1.255
- ^ Ziegler G.R., Creek J.A., Runt J. Spherulitic crystallization in starch as a model for starch granule initiation. Biomacromolecules 2005;6(3):1547-54. doi:10.1021/bm049214p