La via di Leloir è la principale via per il metabolismo del galattosio.
Descritta per la prima volta da Leloir L.F. e colleghi nel 1948, porta alla conversione del galattosio in glucosio-1-fosfato, dunque all’inversione della configurazione del gruppo ossidrilico sul carbonio 4 (C4) del galattosio, carbonio che è uno dei centri di chiralità della molecola.[1]
Gli intermedi metabolici che portano alla isomerizzazione del galattosio a glucosio sono precursori utilizzati in vie metaboliche differenti, quali le reazioni di glicosilazione dei lipidi e proteine o la sintesi del glicogeno, a seconda della fase dello sviluppo, del tipo di tessuto e delle condizioni metaboliche presenti.[2]
Con l’esclusione della prima reazione, le altre reazioni della via di Leloir possono fluire in entrambe le direzioni, a seconda del livello dei substrati e delle richieste metaboliche del tessuto, il che permette l’interconversione di galattosio e glucosio.[3]
L’importanza della via di Leloir, e quindi del galattosio, è sottolineata dal fatto che è estremamente conservata in natura, essendo presente dai batteri fino alle piante e animali.[4] Nell’uomo, la sua importanza è sottolineata dalla gravità delle conseguenze dovute a mutazioni a carico di dei geni che codificano per gli enzimi che ne catalizzano le reazioni, mutazioni che provocano la malattia metabolica congenita nota come galattosemia.[5]
Indice
- Galattosio
- Tappe della via di Leloir
- Funzioni della via di Leloir
- Via di Leloir e galattosemia
- Bibliografia
Galattosio
Il galattosio, con il glucosio e fruttosio, è uno dei monosaccaridi che può essere assorbito nell’intestino. La principale fonte di galattosio è rappresentata dal lattosio che, con maltosio, trealosio e saccarosio, è uno dei disaccaridi presenti negli alimenti.
Essendo assenti trasportatori intestinali per i disaccaridi, nell’ultima tappa della digestione dei carboidrati i loro legami glicosidici sono idrolizzati con liberazione dei monosaccaridi costituenti, che per il lattosio sono glucosio e galattosio.[6]
Segue l’assorbimento dei monosaccaridi i quali, tramite il sistema portale, raggiungono il fegato, che è il sito principale per il metabolismo del galattosio e ne assorbe, attraverso diffusione passiva mediata dal trasportatore GLUT2, la maggior parte, circa l’88%.[7]
La quantità residua circolante raggiunge altri organi e tessuti, come la ghiandola mammaria che, in fase di allattamento, lo utilizza per la produzione del lattosio e la glicosilazione delle proteine e dei lipidi del latte.[4]
Tappe della via di Leloir
La via di Leloir si compone di quattro reazioni catalizzate da altrettanti enzimi che sono:
- la galattosio mutarotasi o aldoso-1-epimerasi (EC 5.1.3.3);
- la galattochinasi (EC 2.7.1.6);
- la galattosio-1-fosfato uridiltransferasi (EC 2.7.7.12);
- la galattosio 4-epimerasi (EC 5.1.3.2).[8]
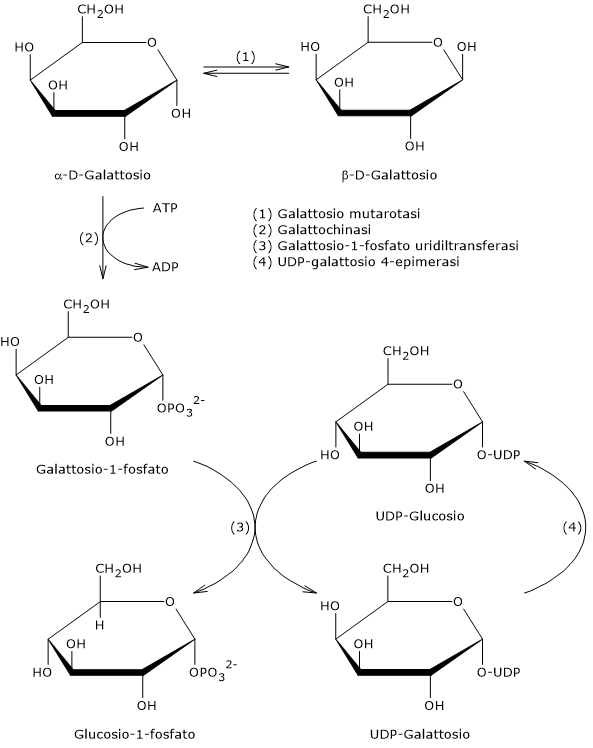
Reazione 1: galattosio mutarotasi
L’idrolisi del legame glicosidico β-(1→4) del lattosio porta alla liberazione di glucosio e β-D-galattosio. Tuttavia il secondo enzima della via di Leloir, la galattochinasi, è specifica per l’α-anomero del galattosio.[8] La conversione del β-anomero nell’α-anomero è catalizzata dalla galattosio mutarotasi. L’enzima è in grado d’interconvertire le configurazioni anomeriche anche del glucosio, dello xilulosio, del maltosio e del lattosio, sebbene con efficienza variabile.[9]
Reazione 2: galattochinasi
Nel secondo passaggio l’α-D-galattosio viene fosforilato a galattosio-1-fosfato nella reazione catalizzata dalla galattochinasi.[8] La fosforilazione del galattosio, al pari della fosforilazione del glucosio a glucosio-6-fosfato, è importante per diverse ragioni.
- Blocca il monosaccaride all’interno della cellula poiché è caricato negativamente e sono assenti sulla membrana plasmatica trasportatori per gli zuccheri fosforilati.[10]
- Ne aumenta il contenuto in energia iniziandone la destabilizzazione il che faciliterà il successivo metabolismo.[11]
- Ne mantiene bassa la concentrazione intracellulare, favorendone l’ulteriore passaggio all’interno della cellula.[10]
La reazione catalizzata dalla galattochinasi è l’unica reazione irreversibile della via di Leloir.[3] Inoltre, a differenza della esochinasi e della glucochinasi (EC 2.7.1.1), che catalizzano la fosforilazione del gruppo ossidrilico sul carbonio 6 (C6) del glucosio, la galattochinasi e la fruttochinasi (EC 2.7.1.4) catalizzano la fosforilazione dei gruppi ossidrilici legati rispettivamente al carbonio 1 (C1) di galattosio e fruttosio.[12]
La conversione del galattosio-1-fosfato a glucosio-1-fosfato richiede due reazioni, rispettivamente la terza e la quarta della via di Leloir.
Reazione 3: galattosio-1-fosfato uridiltransferasi
Nel terzo passaggio la galattosio-1-fosfato uridiltransferasi catalizza il trasferimento del gruppo UMD dall’UDP-glucosio al galattosio-1-fosfato, con formazione di UDP-galattosio e glucosio-1-fosfato. La reazione procede con un meccanismo a ping-pong con formazione di un intermedio covalente tra l’enzima e l’UMP.[10]
Reazione 4: UDP-galattosio 4-epimerasi
Nell’ultimo passaggio l’UDP-galattosio viene convertito in UDP-glucosio nella reazione catalizzata dalla UDP-galattosio 4-epimerasi.
L’enzima catalizza l’inversione della configurazione del gruppo ossidrilico sul C4 ed è il punto di interconversione tra UDP-galattosio e UDP-glucosio, e quindi, e, per estensione, tra galattosio e glucosio.[13]
L’enzima richiede come cofattore il NAD+ e la reazione procede attraverso la formazione di un intermedio chetonico sul C4, con contemporanea riduzione del NAD+ a NADH. Successivamente l’intermedio chetonico ruota presentando la faccia opposta dello zucchero al NADH. A questo punto uno ione idruro viene ritrasferito dal NADH al C4, ma in configurazione opposta.[14]
Poiché il NAD nel corso della reazione viene prima ridotto e poi ossidato, non subisce alcuna ossidoriduzione netta per cui non compare nell’equazione di reazione. Sembra che la UDP-galattosio 4-epimerasi sia l’enzima limitante la via di Leloir.[4]
L’UDP-glucosio prodotto viene riciclato nella reazione catalizzata dalla UDP-glucosio pirofosforilasi, con rilascio di glucosio-1-fosfato.[2]
Nei mammiferi la galattosio 4-epimerasi catalizza anche la interconversione tra UDP-N-acetilgalattosammina e UDP-N-acetilglucosammina.[15]
Si noti che UDP-galattosio e UDP-glucosio, o più in generale galattosio e glucosio, hanno la stessa formula molecolare. Sono quindi isomeri e differiscono solo per la configurazione del quarto atomo di carbonio. Pertanto sono un esempio di isomeria ottica.
Funzioni della via di Leloir
La via di Leloir permette alla cellula di utilizzare il galattosio o il glucosio derivato in diverse vie metaboliche, sia anaboliche che cataboliche, a seconda delle condizioni metaboliche della cellula o del tessuto. Inoltre, poiché la reazione catalizzata dalla UDP-galattosio 4-epimerasi è reversibile, è possibile la conversione del glucosio a galattosio e derivati nucleotidici.[2]
L’UDP-galattosio può essere utilizzato:
- nelle reazioni di glicosilazioni di proteine e lipidi, come i galattocerebrosidi che sono i principali glicolipidi della mielina, ed è per questo che il galattosio fu inizialmente chiamato cerebrosio;[4][16]
- nella ghiandola mammaria in allattamento per la produzione del lattosio nella reazione catalizzata dal complesso della lattosio sintasi.[17]
Inoltre, essendo la reazione catalizzata dalla UDP-galattosio 4-epimerasi reversibile sarà anche possibile la conversione del glucosio, previa attivazione a UDP-glucosio nella reazione catalizzata dalla UDP-glucosio pirofosforilasi (EC 2.7.7.9), in UDP-galattosio per la sintesi del lattosio.[18]
Nel fegato e nel muscolo scheletrico l’UDP-glucosio derivante dell’UDP-galattosio, può essere utilizzato:[3]
- nelle reazioni di glicosilazione dei lipidi e delle proteine;
- nella sintesi del glicogeno, quando la richiesta energetica della cellula è bassa; e, rispetto al glucosio e fruttosio, il galattosio è preferenzialmente incorporato nel glicogeno epatico piuttosto che essere indirizzato verso il metabolismo ossidativo;
- a seguito della conversione in glucosio-1-fosfato, nella reazione catalizzata dalla UDP-glucosio pirofosforilasi, e isomerizzazione a glucosio-6-fosfato, nella reazione catalizzata dalla fosfoglucomutasi, può entrare in vie metaboliche differenti quali la glicolisi, la via del pentoso fosfato o la gluconeogenesi.[4]
Nota: l’UDP-galattosio è stato il primo zucchero nucleotidico a essere scoperto, scoperta avvenuta proprio nel corso degli studi sulla via di Leloir.[19]
Via di Leloir e galattosemia
Le glicosilazioni sono modificazioni post-traduzionali che hanno un ruolo importante nel rendere possibili e regolare differenti processi biologici. Difetti a loro carico sono stati correlati a molte condizioni patologiche come cancro, diabete ed errori congeniti del metabolismo quali i disturbi congeniti della glicosilazione, principalmente disordini monogenici autosomici recessivi.[20] Tra questi ultimi si annovera la galattosemia, descritta per la prima volta nel 1908 da von Reuss A.[21] La galattosemia è conseguente a mutazioni a carico di uno dei geni che codificano per i quattro enzimi della via di Leloir, e ne sono stati individuati quattro tipi.
- Tipo I, da carenza di galattosio-1-fosfato uridiltransferasi, la forma più comune, anche detta galattosemia classica.[22]
- Tipo II, da carenza di galattochinasi.[23]
- Tipo III, da carenza di galattosio 4-epimerasi.[24]
- Tipo IV, da carenza di galattosio mutarotasi.[25]
A oggi, lo standard terapeutico per la cura della galattosemia è una dieta a ridotto contenuto di galattosio.[26]
Galattosemia e cataratta
L’accumulo di galattosio ha quale effetto quello di attivare vie metaboliche alternative quali la sintesi del galattitolo e del galattonato.
Tra i sintomi della galattosemia si ritrova la comparsa precoce di cataratta, in genere entro i primi due anni di vita, e nei casi più severi danni al cervello, reni e fegato.[9]
Sembra che uno dei fattori che determinano l’insorgenza della cataratta sia la riduzione del galattosio, accumulatosi nella lente dell’occhio, a galattitolo, nella reazione catalizzata dalla aldoso reduttasi (EC 1.1.1.21).[27] Il galattitolo, un poliolo scarsamente metabolizzato, non diffonde attraverso la membrana plasmatica a causa della sua scarsa lipofilicità, ed essendo un composto osmoticamente molto attivo determina un aumento della pressione osmotica intracellulare, con conseguente richiamo d’acqua nella lente.[28]
Inoltre la sua sintesi, riducendo i livelli intracellulari di NADPH, può determinare una riduzione dell’attività della glutatione reduttasi (EC 1.8.1.7) causando un accumulo di radicali liberi.[29]
L’effetto osmotico e l’accumulo di radicali liberi possono danneggiare l’integrità della cellula e causarne la morte. Inoltre, è stato riportato che il galattitolo è un inibitore della galattosio mutarotasi, per cui il suo accumulo potrebbe causare un ulteriore accumulo di galattosio non metabolizzato.[30]
Bibliografia
- ^ Leloir L.F., de Fekete M.A., Cardini C.E. Starch and oligosaccharide synthesis from uridine diphosphate glucose. J Biol Chem 1961;236:636-41. doi:10.1016/S0021-9258(18)64280-2
- ^ a b c Frey P.A. The Leloir pathway: a mechanistic imperative for three enzymes to change the stereochemical configuration of a single carbon in galactose. FASEB J 1996;10(4):461-70. doi:10.1096/fasebj.10.4.8647345
- ^ a b c Conte F., van Buuringen N., Voermans N.C., Lefeber D.J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: time for a closer look. Biochim Biophys Acta Gen Subj 2021;1865(8):129898. doi:10.1016/j.bbagen.2021.129898
- ^ a b c d e Coelho A.I., Berry G.T., Rubio-Gozalbo M.E. Galactose metabolism and health. Curr Opin Clin Nutr Metab Care 2015;18(4):422-427. doi:10.1097/MCO.0000000000000189
- ^ Petry K.G., Reichardt J.K. The fundamental importance of human galactose metabolism: lessons from genetics and biochemistry. Trends Genet 1998;14(3):98-102. doi:10.1016/s0168-9525(97)01379-6
- ^ Coelho A.I., Rubio-Gozalbo M.E., Vicente J.B., Rivera I. Sweet and sour: an update on classic galactosemia. J Inherit Metab Dis 2017;40(3):325-342. doi:10.1007/s10545-017-0029-3
- ^ Drozdowski L.A., Thomson A.B. Intestinal sugar transport. World J Gastroenterol 2006;12(11):1657-70. doi:10.3748/wjg.v12.i11.1657
- ^ a b c Holden H.M., Rayment I., Thoden J.B. Structure and function of enzymes of the Leloir pathway for galactose metabolism. J Biol Chem 2003;278(45):43885-43888. doi:10.1074/jbc.R300025200
- ^ a b Thoden J.B., Timson D.J., Reece R.J., and M. Holden H.M. Molecular structure of human galactose mutarotase. J Biol Chem 2004;279(22):23431-23437. doi:10.1074/jbc.M402347200
- ^ a b c Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010.
- ^ Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5th Edition. W. H. Freeman and Company, 2002.
- ^ Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., 2009.
- ^ Thoden J.B., Holden H.M. Dramatic differences in the binding of UDP-galactose and UDP-glucose to UDP-galactose 4-epimerase from Escherichia coli. Biochemistry 1998;37(33):11469-77. doi:10.1021/bi9808969
- ^ Thoden J.B., Wohlers T.M., Fridovich-Keil J.L., Holden H.M. Human UDP-galactose 4-epimerase. Accommodation of UDP-N-acetylglucosamine within the active site. J Biol Chem 2001;276(18):15131-6. doi:10.1074/jbc.M100220200
- ^ Demirbas D., Coelho A.I., Rubio-Gozalbo M.E., Berry G.T. Hereditary galactosemia. Metabolism. 2018;83:188-196. doi:10.1016/j.metabol.2018.01.025
- ^ Helenius A., Aebi M. Intracellular functions of N-linked glycans. Science 2001;291(5512):2364-9. doi:10.1126/science.291.5512.2364
- ^ Lin Y., Sun X., Hou X., Qu B., Gao X., Li Q. Effects of glucose on lactose synthesis in mammary epithelial cells from dairy cow. BMC Vet Res 2016;12:81. doi:10.1186/s12917-016-0704-x
- ^ Sunehag A., Tigas S., Haymond M.W. Contribution of plasma galactose and glucose to milk lactose synthesis during galactose ingestion. J Clin Endocrinol Metab 2003;88(1):225-9. doi:10.1210/jc.2002-020768
- ^ Cardini C.E., Paladini A.C., Caputto R., Leloir L.F. Uridine diphosphate glucose: the coenzyme of the galactose-glucose phosphate isomerization. Nature 1950;165:191-192. doi:10.1038/165191a0
- ^ Dall’Olio F. Glycobiology of aging. Subcell Biochem 2018;90:505-526. doi:10.1007/978-981-13-2835-0_17
- ^ Timson D.J. Type IV galactosemia. Genet Med 2019;21:1283-1285. doi:10.1038/s41436-018-0359-z
- ^ Los E., Ford G.A. Galactose-1-phosphate uridyltransferase deficiency. [Updated 2023 Jul 17]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK441957/
- ^ Ramani P.K., Arya K. Galactokinase deficiency. [Updated 2023 Jul 31]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK560683/
- ^ Fridovich-Keil J., Bean L., He M., et al. Epimerase deficiency galactosemia. 2011 Jan 25 [Updated 2021 Mar 4]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK51671/
- ^ Wada Y., Kikuchi A., Arai-Ichinoi N., Sakamoto O., Takezawa Y., Iwasawa S., Niihori T., Nyuzuki H., Nakajima Y., Ogawa E., Ishige M., Hirai H., Sasai H., Fujiki R., Shirota M., Funayama R., Yamamoto M., Ito T., Ohara O., Nakayama K., Aoki Y., Koshiba S., Fukao T., Kure S. Biallelic GALM pathogenic variants cause a novel type of galactosemia. Genet Med 2019;21(6):1286-1294. doi:10.1038/s41436-018-0340-x
- ^ Succoio M., Sacchettini R., Rossi A., Parenti G., Ruoppolo M. Galactosemia: biochemistry, molecular genetics, newborn screening, and treatment. Biomolecules 2022;12(7):968. doi:10.3390/biom12070968
- ^ Pintor J. Sugars, the crystalline lens and the development of cataracts. Biochem Pharmacol 2012;1:4. doi:10.4172/2167-0501.1000e119
- ^ Tsakiris S., Marinou K., Schulpis K. H. The in vitro effects of galactose and its derivatives on rat brain Mg2+-ATPase activity. Pharmacol Toxicol 2022;91:254-257. doi:10.1034/j.1600-0773.2002.910506.x
- ^ Lai K., Elsas L.J., Wierenga K.J. Galactose toxicity in animals. IUBMB Life 2009;61(11):1063-74. doi:10.1002/iub.262
- ^ Keston A.S. Inhibition of action of lens mutarotase on glucose by cataractogenic sugars and corresponding polyols. Arch Biochem Biophys 1963;102(2):306-312. doi:10.1016/0003-9861(63)90184-X