Il tè verde, al pari degli altri tipi di tè, è un infuso di foglie lavorate di Camellia sinensis, un membro della famiglia delle Theaceae.
La lavorazione delle foglie che porterà al prodotto pronto per l’infusione è tale da ridurre al minimo i processi ossidativi, sia enzimatici che chimici, a carico delle sostanze in esse contenute, in particolare i fitochimici come le catechine, polifenoli appartenenti alla classe dei flavonoidi e le principali responsabili dei benefici per la salute ascritti al tè verde.
Avendo subito modificazioni chimiche poco significative, le foglie mantengono il loro colore verde, mentre la bevanda, da ottenersi utilizzando un filtro a persona, o nel caso del tè sfuso un cucchiaino a persona, per un tempo di infusione circa tre minuti in acqua a 75 °C, è di colore giallo oro.
Ed è al tipo di lavorazione delle foglie che si deve parte delle peculiari proprietà organolettiche della bevanda, come il sapore, che risulta più delicato e leggero rispetto a quello del tè nero, e le sue proprietà salutari, da sempre riconosciute nella cultura orientale.
Solo di recente la comunità scientifica ha iniziato a studiarne i benefici per la salute, riconoscendone il valore preventivo riguardo lo viluppo di molte malattie, come le malattie cardiovascolari e alcuni tipi di tumore.
E’ stato dimostrato che i polifenoli del tè, in particolare le catechine, sono in grado di attivare vie di segnalazione intracellulari a seguito del legame a specifici recettori di membrana e/o al passaggio all’interno della cellula dove poi si legano a specifici recettori citoplasmatici, mitocondriali o nucleari, in entrambe i casi attivando o inibendo, a seconda del tipo cellulare, determinati processi cellulari.
Dato l’elevato consumo di tè a livello mondiale, anche piccoli effetti sulla salute delle persone potrebbero avere grandi effetti sulla salute pubblica.
Indice
Camellia sinensis
Camellia sinensis è una pianta sempre verde originaria del Sud, Est, e Sud-Est asiatico, che attualmente viene coltivata in almeno 30 paesi, principalmente con clima sub-tropicale o tropicale, sebbene ci siano varietà coltivate in Cornovaglia e nello stato di Washington.
In natura, se indisturbata, può crescere fino a 15-20 metri, mentre nelle piantagioni è tenuta, per facilitarne la coltivazione e la raccolta delle foglie, a un’altezza inferiore al metro e mezzo.
La sua coltivazione si può spingere fino a 1500-2000 metri di altitudine, e molte delle varietà più pregiate di tè sono ottenute da coltivazioni montane grazie al fatto che la pianta cresce più lentamente permettendo alla foglia di acquisire più aromi.
Le varianti maggiormente coltivate, delle quattro conosciute, sono Camellia sinensis var. sinensis, originaria della Cina, e Camellia sinensis var. assamica, originaria dell’India.
Per la produzione delle differenti varietà di tè sono utilizzate le foglie fresche, tra le quali sono scelte le più giovani poiché quelle vecchie sono ritenute di qualità inferiore.
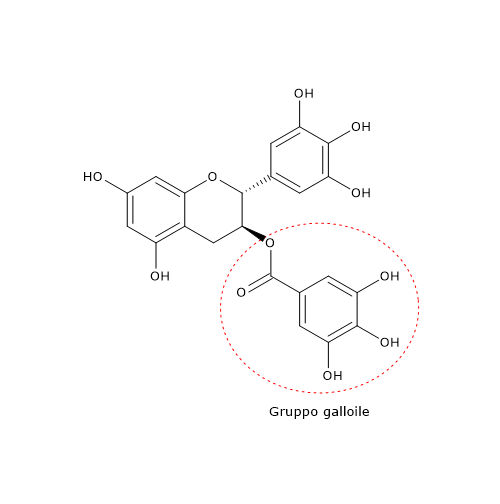
Le foglie fresche sono ricche di polifenoli solubili in acqua, in particolare catechine e catechine glicosilate. Le principali catechine presenti sono l’epigallocatechina-3-gallato o EGCG, la più attiva, l’epigallocatechina, la epicatechina-3-gallato, l’epicatechina. Sono presenti, anche se in quantità minore, la catechina, la gallocatechina, la catechina gallato e la gallocatechina gallato.
Questi polifenoli costituiscono il 30-42% del peso secco della foglia. La caffeina costituisce circa il 3% del peso secco della foglia, con variazioni dall’1,4 al 4,5%.
Il cultivar, le caratteristiche del suolo, i metodi di coltivazione, l’altitudine, il clima, il periodo dell’anno in cui avviene la raccolta delle foglie, ovviamente assieme alla lavorazione delle foglie, sono tutti fattori che influenzeranno le caratteristiche organolettiche della bevanda.
Come si produce il tè verde?
Le differenze nella lavorazione delle foglie, che portano alla produzione dei diversi tipi di tè, causano differenti gradi di ossidazione delle sostanze in esse presenti, soprattutto delle catechine.
La lavorazione che porta alla produzione del tè verde è tale da ridurre al minimo i processi ossidativi, sia enzimatici che non enzimatici.
Dopo la raccolta, le foglie sono esposte al sole per 2-3 ore e fatte appassire/asciugare. Di seguito, la lavorazione vera e propria procede attraverso tre fasi principali:
- trattamento termico;
- arrotolamento;
- essicazione.
Il trattamento termico, breve e delicato, è il passaggio cruciale per la qualità e le proprietà finali della bevanda. Può essere effettuato sia con il vapore, che è il metodo tradizionale giapponese, che mediante cottura a secco in pentole calde, dei grandi wok, una sorta di torrefazione, che è il metodo tradizionale cinese. Il trattamento termico permette di inattivare gli enzimi presenti nei tessuti fogliari bloccando i processi di ossidazione enzimatica, in particolare quelli a carico dei polifenoli. Inoltre elimina l’odore d’erba, facendo così risaltare quello del tè, e fa evaporare, nel caso del metodo tradizionale cinese, parte dell’acqua della foglia, di cui ne costituisce circa il 75% del peso, rendendola più morbida, così da facilitare il passaggio successivo.
Al trattamento termico segue una fase di arrotolamento che ha lo scopo di facilitare la fase successiva di essiccamento e di distruggere il tessuto fogliare al fine di favorire il rilascio degli aromi della foglia, migliorando la qualità del prodotto.
L’ultima fase è quella dell’essiccazione, che comporta anche la formazione di nuovi composti e migliora l’aspetto del prodotto.
Benefici per la salute
L’assunzione di tè è da sempre associata, almeno nella cultura orientale, Cina e Giappone in primis, a benefici per la salute. Di seguito una breve rassegna di risultati di studi epidemiologici e di laboratorio che hanno indagato il ruolo preventivo che l’assunzione di tè verde può avere nei confronti dello sviluppo di molte patologie. La EGCG, che è la catechina più abbondante presente nel tè verde rappresentando quasi il 60% dei polifenoli presenti nelle foglie secche, sembra svolgere il ruolo principale.
A livello molecolare, per molti degli effetti esercitati dalle catechine sembrano essere essenziali i gruppi galloile presenti nelle posizione 3 e/o 3’.
Malattie cardiovascolari
Le malattie cardiovascolari sono la principale causa di morte nel mondo, in particolare nei paesi a basso e medio reddito, con una stima di 17,3 milioni di decessi nel 2008, valore che potrebbe aumentare fino a 23,3 milioni entro il 2030.
Un consumo giornaliero di tè, soprattutto tè verde, sembra essere associato a una riduzione del rischio della loro comparsa, in particolare ipertensione e ictus.
Tra i meccanismi proposti sembra essere importante l’accresciuta bioattività del monossido di azoto endoteliale, un potente vasodilatatore, dovuta all’azione dei polifenoli che ne aumenterebbero la sintesi e/o ne ridurrebbero la degradazione mediata dall’anione superossido.
Neoplasie
Molti studi epidemiologici e di laboratorio hanno dato risultati incoraggianti riguardo al possibile ruolo preventivo del tè, in particolare il tè verde, nei confronti dello sviluppo di alcune neoplasie quali i tumori del cavo orale, del tratto digestivo, e del polmone tra coloro che non hanno mai fumato.
I polifenoli del tè sembrano agire non solo come antiossidanti, ma anche come molecole che, direttamente, possono influenzare l’espressione genica e l’attività di diverse vie metaboliche.
Attività antivirale
Recenti studi hanno messo in evidenza gli effetti antivirali delle catechine, in particolare della EGCG del tè verde, e delle teaflavine del tè nero, soprattutto nei confronti dei virus a RNA a singolo filamento positivo. A questo tipo di virus appartiene anche la famiglia dei Coronaviridae, che a sua volta comprende sia il SARS-CoV-1 che il SARS-CoV-2.
Le proprietà antivirali della EGCG sembrano essere dovute alle sue caratteristiche strutturali, ossia alla presenza di gruppi pirogallici e galloilici.
Digestione dell’amido
Studi in vitro hanno evidenziato come i polifenoli del tè verde e del tè nero siano in grado di ridurre l’indice glicemico di alimenti ricchi di amido. Di conseguenza potrebbero essere utili nel controllo del loro indice glicemico. L’effetto sembra essere dovuto all’inibizione della alfa-amilasi pancreatica e di altri enzimi digestivi, e a un’interazione diretta tra l’amido e i fitochimici che ridurrebbe la superficie dei granuli di amido disponibile per l’attacco degli enzimi digestivi stessi. Il tè verde appare essere ugualmente efficace sia nei confronti dei cibi contenenti glutine, nei confronti dei quali il tè nero appare meno efficace, che di quelli privi di glutine.
Perdita di peso
Nella fase di perdita di peso, come durante la fase di mantenimento, è importante mantenere il più costante possibile il dispendio energetico giornaliero.
A partire dagli anni ‘90 dello scorso secolo è stato proposto che il tè verde, grazie al suo contenuto in caffeina e catechine fosse di aiuto per:
- mantenere o addirittura aumentare la spesa energetica giornaliera;
- incrementare l’ossidazione dei grassi.
Oltre a questi potenziali effetti termogenici e lipolitici, catechine e caffeina potrebbero essere utili agendo su altri bersagli quali l’assorbimento dei lipidi e l’apporto energetico, forse attraverso il loro impatto sul microbiota intestinale, che è parte del più ampio microbiota umano, e sull’espressione genica.
Sono stati quindi commercializzati prodotti per la perdita di peso e il mantenimento del peso perso a base di estratti di tè verde, contenenti concentrazioni di catechine e caffeina molto maggiori rispetto alla bevanda.
Ma quanto c’è di scientificamente comprovato nelle proprietà “brucia grassi” del tè verde?
La questione sembra essere stata risolta da una accurata meta-analisi di 15 studi che ha analizzato la relazione tra perdita di peso e assunzione dei suddetti prodotti. Lo studio ha evidenziato che i prodotti a base di tè verde inducono, in adulti obesi e in sovrappeso, una diminuzione di peso che:
- non è statisticamente significativa;
- è molto piccola;
- probabilmente non è clinicamente importante.
Quindi, sulla base delle ricerche scientifiche, il tè verde non sembra essere di aiuto nella perdita di peso ne nel mantenimento del peso perso.
Attività anticariogena
Studi in vitro e su animali hanno messo in evidenza che il tè, e nello specifico i suoi polifenoli, sembrano possedere:
- proprietà antibatteriche nei confronti di patogeni ad azione cariogena, come Streptococcus mutans, come nel caso della EGCG del tè verde;
- azione inibitoria sulla amilasi salivare e batterica, ruolo in cui le tearubigine e teaflavine del tè nero sembrano più efficaci delle catechine del tè verde;
- azione inibitoria sulla produzione di acidi nella cavità orale.
Tutte queste caratteristiche rendono il tè verde e il tè nero bevande con una potenziale attività anticariogena.
Bibliografia
- Arab L., Khan F., and Lam H. Tea consumption and cardiovascular disease risk. Am J Clin Nutr 2013;98:1651S-1659S. doi:10.3945/ajcn.113.059345
- Clifford M.N., van der Hooft J.J.J., and Crozier A. Human studies on the absorption, distribution, metabolism, and excretion of tea polyphenols. Am J Clin Nutr 2013;98:1619S-1630S. doi:10.3945/ajcn.113.058958
- Dwyer J.T. and Peterson J. Tea and flavonoids: where we are, where to go next. Am J Clin Nutr 2013;98:1611S-1618S. doi:10.3945/ajcn.113.059584
- Goenka P., Sarawgi A., Karun V., Nigam A.G., Dutta S., Marwah N. Camellia sinensis (Tea): implications and role in preventing dental decay. Phcog Rev 2013;7:152-156. doi:10.4103/0973-7847.120515
- Green R.J., Murphy A.S., Schulz B., Watkins B.A. and Ferruzzi M.G. Common tea formulations modulate in vitro digestive recovery of green tea catechins. Mol Nutr Food Res 2007;51(9):1152-1162. doi:10.1002/mnfr.200700086
- Grassi D., Desideri G., Di Giosia P., De Feo M., Fellini E., Cheli P., Ferri L., and Ferri C. Tea, flavonoids, and cardiovascular health: endothelial protection. Am J Clin Nutr 2013;98:1660S-1666S. doi:10.3945/ajcn.113.058313
- Huang W-Y., Lin Y-R., Ho R-F., Liu H-Y., and Lin Y-S. Effects of water solutions on extracting green tea leaves. Sci World J 2013;Article ID 368350. doi:10.1155/2013/368350
- Hursel R. and Westerterp-Plantenga M.S. Catechin- and caffeine-rich teas for control of body weight in humans. Am J Clin Nutr 2013;98:1682S-1693S. doi:10.3945/ajcn.113.058396
- Hursel R., Viechtbauer W. and Westerterp-Plantenga M.S. The effects of green tea on weight loss and weight maintenance: a meta-analysis. Int J Obesity 2009;33:956-961. doi:10.1038/ijo.2009.135
- Jurgens T.M., Whelan A.M., Killian L., Doucette S., Kirk S., Foy E. Green tea for weight loss and weight maintenance in overweight or obese adults. Editorial group: Cochrane Metabolic and Endocrine Disorders Group. 2012:12 Art. No.: CD008650. doi:10.1002/14651858.CD008650.pub2
- Lambert J.D. Does tea prevent cancer? Evidence from laboratory and human intervention studies. Am J Clin Nutr 2013;98:1667S-1675S. doi:10.3945/ajcn.113.059352
- Lorenz M. Cellular targets for the beneficial actions of tea polyphenols. Am J Clin Nutr 2013;98:1642S-1650S. doi:10.3945/ajcn.113.058230
- Mathur A., Gopalakrishnan D., Mehta V., Rizwan S.A., Shetiya S.H., Bagwe S. Efficacy of green tea-based mouthwashes on dental plaque and gingival inflammation: a systematic review and meta-analysis. Indian J Dent Res 2018;29(2):225-232. doi:10.4103/ijdr.IJDR_493_17
- Mhatre S., Srivastava T., Naik S., Patravale V. Antiviral activity of green tea and black tea polyphenols in prophylaxis and treatment of COVID-19: a review. Phytomedicine 2020;153286. doi:10.1016/j.phymed.2020.153286
- Sharma V.K., Bhattacharya A., Kumar A. and Sharma H.K. Health benefits of tea consumption. Trop J Pharm Res 2007;6(3):785-792.
- Yang Y-C., Lu F-H., Wu J-S., Wu C-H., Chang C-J. The protective effect of habitual tea consumption on hypertension. Arch Intern Med 2004;164:1534-1540. doi:10.1001/archinte.164.14.1534
- Yuan J-M. Cancer prevention by green tea: evidence from epidemiologic studies. Am J Clin Nutr 2013;98:1676S-1681S. doi:10.3945/ajcn.113.058271
- Xu J., Xu Z., Zheng W. A review of the antiviral role of green tea catechins. Molecules 2017;22(8):1337. doi:10.3390/molecules22081337
