Il tratto gastrointestinale dell’uomo è una delle più feroci e competitive nicchie ecologiche presenti in natura. Vi si ritrovano virus, eucarioti, batteri, e una sola specie di Archeobatteri, Methanobrevibacter smithii.
I batteri variano in proporzione e quantità lungo tutto il tratto gastrointestinale. La presenza maggiore si ha nel colon, con oltre 400 specie diverse appartenenti a 9 fila o divisioni, ed è a questi che ci si riferirà parlando di microbiota intestinale, che a sua volta è parte del più ampio microbiota umano. Di seguito, l’elenco dei phyla suddetti e di alcuni tra i loro generi maggiormente rappresentati.
- Actinobacteria, Gram-positivi; Bifidobacterium, Collinsella, Eggerthella e Propionibacterium.
- Bacteroidetes, Gram-negativi; oltre 20 generi tra cui Bacteroides, Prevotella e Corynebacterium.
- Cyanobacteria, Gram-negativi.
- Firmicutes, Gram-positivi; almeno 250 generi tra cui Mycoplasma, Bacillus, Clostridium, Dorea, Faecalibacterium, Ruminococcus, Eubacterium, Staphylococcus, Streptococcus, Lactobacillus, Lactococcus,Enterococcus, Sporobacter e Roseburia.
- Fusobacteria, Gram-negativi; Sneathia.
- Lentisphaerae, Gram-negativi.
- Proteobacteria, Gram-negativi; Escherichia, Klebsiella, Shigella, Salmonella, Citrobacter, Helicobacter e Serratia.
- Spirochaeates, Gram-negativi.
- Verrucomicrobia, Gram-negativi.
La presenza nel colon di un piccolo sottoinsieme del mondo batterico, 9 phyla sui 30 esistenti nel dominio Bacteria, è il risultato di una forte pressione selettiva che nel corso dell’evoluzione ha agito sia sui colonizzatori microbici, selezionando organismi adattati eccezionalmente bene a questo ambiente e in grado di dominare il processo di colonizzazione, che sulla nicchia intestinale. E tuttavia, ciascun individuo possiede nel proprio intestino una comunità batterica unica.
Nonostante la grande variabilità esistente sia riguardo ai taxa presenti che tra gli individui, è stato proposto, ma non da tutti accettato, che nella maggior parte dei soggetti adulti il microbiota intestinale, nella sua componente batterica, possa essere classificato in varianti o “enterotipi” sulla base del rapporto tra l’abbondanza di Bacteroides e Prevotella. Questo sembra indicare che esista un numero limitato di stati simbiotici ben bilanciati, che potrebbe rispondere in maniera differente a fattori quali la dieta, l’età, la genetica e l’assunzione di farmaci.
L’intestino degli adulti ospita un’ampia e varia comunità di virus a DNA e RNA, formata da circa 2000 genotipi differenti, dove però non se ne individua uno dominante, considerando che il virus più abbondante rappresenta solo circa il 6% dell’intera comunità, al contrario di ciò che accade nei neonati dove il genotipo più abbondante rappresenta oltre il 40% dell’intera comunità. La maggior parte dei virus a DNA sono batteriofagi o fagi, ossia virus che infettano i batteri, che sono anche l’entità biologica più abbondante presente sulla terra, con un una popolazione stimata di circa 1031 unità, mentre la maggior parte di quelli a RNA sono virus vegetali.
Indice
- Influenze sulla composizione e sviluppo del microbiota intestinale
- Composizione nel corso della vita
- Bibliografia
Influenze sulla composizione e sviluppo del microbiota intestinale
La comunità batterica intestinale è regolata da diversi fattori, molti dei quali sono di seguito elencati.
- La dieta
La dieta dell’ospite sembra essere il fattore più importante, a partire dal primo alimento assunto, il latte materno.
Sebbene considerato sterile, il latte materno contiene un ricco microbiota formato da oltre 700 specie, dominato da stafilococchi, streptococchi, bifidobatteri e batteri lattici. Dunque, nei i bambini allattati al seno rappresenta una fonte importante per la colonizzazione dell’intestino, ed è stato suggerito che questa modalità di colonizzazione giochi un ruolo cruciale per la salute, in quanto, tra le altre funzioni potrebbe proteggere il neonato dalle infezioni e contribuire alla maturazione del sistema immunitario. Il latte materno influenza il microbiota intestinale anche indirettamente, grazie alla presenza di oligosaccaridi con attività prebiotica che stimolano la crescita di gruppi batterici specifici quali stafilococchi e bifidobatteri.
Anche uno studio che ha confrontato il microbiota intestinale di bambini europei e africani, rispettivamente da Firenze e un villaggio rurale del Burkina Faso, di età compresa tra 1 e 6 anni, ha messo in evidenza il ruolo decisivo della dieta rispetto ad altre variabili quali il clima, la geografia, l’igiene e i servizi sanitari; è stata inoltre osservata un’assenza di differenze significative nell’espressione di geni chiave nel regolare la funzione immune, che suggerisce quindi una similarità funzionale tra i due gruppi. Infatti i bambini di entrambe i gruppi, fintanto che sono allattati al seno, presentano un microbiota intestinale con caratteristiche molto simili, ricco in Actinobacteria, principalmente Bifidobacterium.
La successiva introduzione di una dieta solida differente nei due gruppi, di tipo Occidentale negli europei e dunque ricca in grassi e proteine animali, povera in proteine animali ma ricca in carboidrati complessi nei bambini africani, porta a una differenziazione del rapporto Firmicutes/Bacteroidetes nei due gruppi. Nei bambini europei erano più abbondanti i Gram-positivi, principalmente Firmicutes, rispetto ai Gram-negativi, mentre nei bambini africani prevalevano i Gram-negativi, principalmente Bacteroidetes, rispetto ai Gram-positivi.
E la dieta a lungo termine è associata in modo molto stretto alla ripartizione in enterotipi. E’ stato infatti osservato che:
una dieta ricca in grassi e proteine animali, dunque di tipo occidentale, porta a un microbiota intestinale dominato da taxa dell’enterotipo Bacteroides;
una dieta ricca in carboidrati, tipica delle società agricole, vede la prevalenza dell’enterotipo Prevotella.
Analoghi risultati sono emersi dallo studio sopracitato sui bambini. Negli europei, il microbiota intestinale era dominato da taxa tipici dell’enterotipo Bacteroides, mentre in quelli del Burkina Faso, dominano taxa dell’enterotipo Prevotella.
Con cambiamenti a breve termine della dieta, 10 giorni, quali il passaggio da una povera in grassi e ricca in fibre a una ricca in grassi e povera in fibre e viceversa, sono stati osservati cambiamenti nella composizione del microbioma, già dopo 24 ore, ma nessuno scambio stabile nella suddivisione in enterotipi. E questo rimarca come per un cambiamento dell’enterotipo del microbiota intestinale sia necessaria una dieta a lungo termine.
Modifiche a carico della dieta si traducono anche in cambiamenti a carico del viroma intestinale, che si sposta verso un nuovo stato, ossia si osservano alterazioni delle proporzioni delle popolazioni preesistenti, verso il quale convergono individui che seguano la stessa dieta.
- Il pH, sali biliari ed enzimi digestivi
Lo stomaco, a causa del pH estremamente acido del suo contenuto, è un ambiente ostile per i batteri, che non sono presenti in numero elevato, circa 102-103 cellule batteriche/grammo di tessuto. Oltre a Helicobacter pylori, capace di causare gastriti e ulcere gastriche, sono presenti anche batteri del genere Lactobacillus.
Dal duodeno si osserva un incremento nel numero di unità, 104-105 cellule batteriche/grammo di tessuto; e quantità simili si ritrovano nel digiuno e nelle prime parti dell’ileo. Il numero contenuto di microorganismi presente nell’intestino tenue è dovuto all’ambiente inospitale conseguente al fatto che nel tratto discendente del duodeno è presente l’apertura dell’ampolla di Vater dalla quale viene riversata la bile e il succo pancreatico ossia sali biliari ed enzimi pancreatici, entrambe in grado di causare danni ai microrganismi presenti.
Nella porzione terminale dell’ileo, dove l’attività dei sali biliari e degli enzimi pancreatici è meno intensa, la conta batterica è di circa 107 cellule batteriche/grammo di tessuto, fino ad arrivare nel colon a valori pari a 1012-1014 cellule batteriche/grammo di tessuto, tanto che le feci sono costituite per il 40% da batteri.
La distribuzione di batteri lungo l’intestino è strategica. Nel duodeno e nel digiuno la quantità di nutrienti ancora disponibile è molto più alta rispetto a quella presente nell’ileo terminale, dove sono rimasti acqua, fibre, ed elettroliti. Dunque non è un problema trovare nell’ileo terminale, e ancor più nel colon, un numero elevato di batteri. Il problema sarebbe trovarli in numero eccessivo nel duodeno, digiuno e prima parte dell’ileo; ed esiste una condizione patologia, definita sindrome da sovracrescita batterica nel tenue o SIBO, acronimo dell’inglese small intestinal bacterial overgrowth, nella quale il numero di batteri nel tenue aumenta di circa 10-15 volte, il che li mette in condizione di poter competere con l’ospite per i nutrienti e dare origine a disturbi gastrointestinali quali ad esempio diarrea. - La posizione geografica e le conseguenti differenze riguardo lo stile di vita, di alimentazione, di religione ecc.
E’ stato ad esempio osservata una sorta di gradiente geografico nel microbiota dei neonati europei, con un numero più elevato di specie di Bifidobacterium e alcune di Clostridium nei bambini delle zone settentrionali, mentre in quelli delle zone meridionali è stata trovata una maggiore abbondanza di Bacteroides, Lactobacillus ed Eubacterium. - La modalità di nascita.
- L’assetto genetico dell’ospite.
- Lo stato di salute, anche della madre nel corso della gravidanza.
Ad esempio, in pazienti con malattia infiammatoria intestinale o IBD, acronimo dell’inglese inflammatory bowel disease, risulta depleta Faecalibacterium prausnitzii, una tra le specie produttrici di acido butirrico, un’importante fonte di energia per le cellule intestinali, e dotata anche di un’azione antiinfiammatoria in vitro e nei topi, mentre si osserva un aumento nel numero di Escherichia coli aderenti. - L’assunzione di antibiotici.
- Le infezioni batteriche e i predatori.
- Le batteriocine, ossia proteine dotate di attività antibatterica, e i batteriofagi.
Questi ultimi sono una forza importante nel controllo dell’abbondanza e composizione del microbiota intestinale. In particolare potrebbero avere un ruolo di primo piano nel corso della colonizzazione dell’intestino del neonato, infettando via via gli ospiti dominanti e creando così l’opportunità per un altro ceppo di divenire abbondante. Questo modello di dinamiche preda-predatore, definito “kill the winner”, suggerisce che le fioriture di determinate specie batteriche porterebbero a fioriture dei loro corrispondenti fagi, seguite da riduzioni dell’abbondanza di entrambe. Di conseguenza il genotipo fagico più abbondante non sarà lo stesso in momenti differenti. E sebbene alcune sequenze virali presenti nell’intestino del neonato siano stabili nel corso dei primi tre mesi di vita, sono state osservate drammatiche variazioni nella composizione complessiva della comunità virale fecale tra la prima e la seconda settimana. Infine, anche la comunità batterica nel corso di questo periodo è estremamente dinamica. - La competizione per lo spazio e i nutrienti.
Composizione nel corso della vita
Lo sviluppo dell’ecosistema microbico intestinale è un evento complesso e cruciale nella vita dell’uomo, altamente variabile da individuo a individuo, e influenzato dai fattori visti in precedenza.
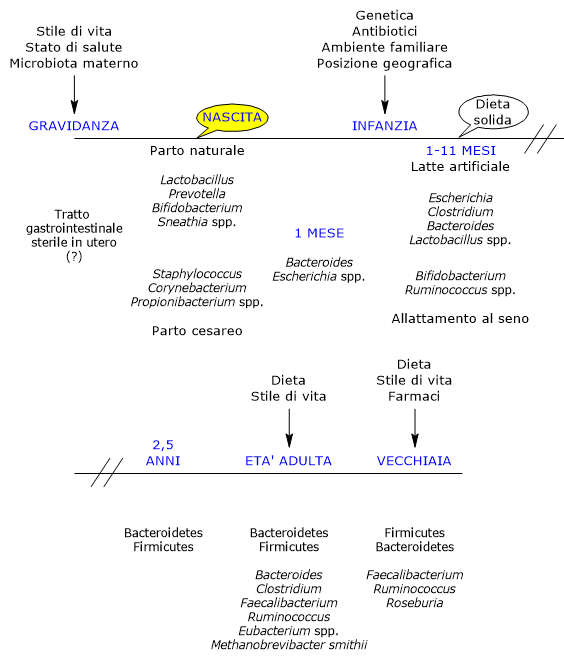
Nell’utero materno i bambini sono considerati sterili, e dunque soggetti al momento del parto alla colonizzazione da parte dei microbi, grazie anche al fatto di nascere con una tolleranza immunitaria “insegnata” dalla madre.
Tuttavia alcuni lavori stanno evidenziando la presenza di batteri nel tessuto placentare, nel sangue del cordone ombelicale, nelle membrane fetali e nel liquido amniotico di neonati sani senza indicazioni di infezioni o infiammazioni. E ad esempio, il meconio di neonati prematuri nati da madri sane contiene un microbiota specifico, con i Firmicutes come phylum principale e predominanza di stafilococchi, mentre nelle prime feci i più abbondanti sono i Proteobacteria, in particolare specie quali Escherichia coli, Klebsiella pneumoniae, Serratia marcescens, ma anche gli enterococchi.
Nota: il meconio è privo di particelle virali rilevabili.
Sembra che sia i batteri vaginali che quelli intestinali possano avere accesso al feto, anche se attraverso vie differenti: per via ascendente i primi, tramite le cellule dendritiche del sistema immunitario i secondi. Dunque potrebbe esistere anche un microbiota fetale.
Al momento del parto si verifica la colonizzazione ad opera di un piccolo inoculo di origine materna, formato in genere da aerobi obbligati e facoltativi (inizialmente l’intestino contiene ossigeno), poi sostituiti da anaerobi obbligati, i batteri tipici presenti nell’età adulta, cui i primi colonizzatori hanno preparato l’ambiente idoneo.
Inoltre è presente un basso numero di taxa differenti, con dominio relativo dei phyla Proteobacteria e Actinobacteria, che rimane tale anche durante il primo mese di vita, ma non nei successivi dove si verifica un grande aumento della variabilità, parallelo a quello di nuove varianti genetiche. Si ritiene che l’esposizione microbica iniziale sia importante nel definire le “traiettorie” che porteranno agli ecosistemi adulti. Infine, le comunità iniziali possono fungere da fonte diretta di batteri protettivi o patogeni molto presto nel corso della vita.
Nei bambini nati con parto naturale le più importanti fonti di inoculo sono il microbiota vaginale e fecale della madre. Infatti i neonati ospitano comunità microbiche dominate dai specie dei generi Lactobacillus, i più abbondanti nel microbiota vaginale e anche nell’intestino neonatale nei primi giorni, Bifidobacterium, Prevotella, o Sneathia. E sembra probabile che gli anaerobi, quali i membri dei phyla Bacteroidetes e Firmicutes, non potendo vivere all’esterno dei loro ospiti, facciano affidamento allo stretto contatto tra genitore e figli per la trasmissione. Infine la trasmissione degli anerobi stretti, data la presenza nell’intestino del neonato di ossigeno, potrebbe avvenire in seguito per mezzo di spore e non direttamente al momento del parto.
In caso di parto cesareo, i primi batteri incontrati sono quelli della pelle e dell’ambiente ospedaliero, e i neonati ospitano un microbiota dominato da specie appartenenti ai generi Corynebacterium, Staphylococcus e Propionibacterium, con una conta batterica intestinale più bassa e una minore diversità nelle prime settimane di vita rispetto ai bimbi nati con parto naturale.
Ulteriore prova che avvalora l’ipotesi di una trasmissione verticale è il fatto che esista una somiglianza tra il microbiota intestinale presente nel meconio, e campioni prelevati dai possibili siti di contaminazione. Queste “firme” materne non persistono indefinitamente, ma vengono sostituite da altre popolazioni microbiche entro il primo anno di vita.
Fonti successive di inoculo sono la bocca e la pelle dei parenti, oggetti, animali, ma sembra essere il latte materno ad avere il ruolo primario nel determinare la successione microbica a livello intestinale.
La variazione e la diversità presente invece tra i bambini rifletterebbe l’individualità di queste esposizioni accidentali.
Nota: il tipo di parto sembra influenzare anche le funzioni immunologiche nel corso del primo anno di vita, forse attraverso l’influenza esercitata sullo sviluppo del microbiota intestinale. I bambini nati con il cesareo avrebbero:
- una più bassa conta di cellule batteriche nei campioni di feci a un mese dalla nascita, dovuta soprattutto alla più elevata presenza di Bifidobacterium nei bambini nati con parto naturale;
- un più alto numero di cellule secretrici anticorpi, IgA, IgG e IgM, il che potrebbe riflettere un’eccessiva esposizione agli antigeni che riuscirebbero ad attraversare la più vulnerabile barriera intestinale.
Entro giorni dalla nascita si viene a creare una fiorente comunità la cui popolazione è molto più variabile in composizione e meno stabile nel tempo rispetto a quella dell’adulto, e che ben presto supererà in numero quella delle cellule del neonato stesso, evolvendo secondo un pattern temporale notevolmente variabile da individuo a individuo.
I virus, assenti alla nascita, dalla fine della prima settimana di vita raggiungono un numero di circa le 108 unità/grammo di peso fresco di feci, e quindi rappresentano una componente abbondante e dinamica del microbiota intestinale in via di sviluppo, ma con una diversità estremamente bassa, al pari di quella batterica. La comunità virale è dominata dai fagi, che probabilmente influenzano anche la diversità e abbondanza dei batteri concomitanti come visto in precedenza. La sorgente iniziale di virus non è nota; tra le possibili fonti ci sono ovviamente quelle materne e ambientali. D’altro canto i primi virus potrebbero essere il risultato dell’induzione dei profagi della “neonata” flora batterica, ipotesi avvalorata dall’osservazione che oltre il 25% delle sequenze fagiche sembrano essere molto simili a quelle dei fagi che infettano batterici come Lactobacillus, Lactococcus, Enterococcus, e Streptococcus, abbondanti nel latte materno.
Dal termine del primo mese di vita si ritiene che la fase iniziale di rapida acquisizione di microbi seguente alla nascita sia terminata.
Dal punto di vista tassonomico nei bambini di un mese i microrganismi più abbondanti sembrano essere quelli appartenenti ai generi Bacteroides ed Escherichia, mentre i Bifidobacterium compaiono e crescono fino a dominare, assieme a Ruminococcus, il tratto gastrointestinale del bambino allattato al seno tra il primo e l’undicesimo mese di vita.
I bifidobatteri, come Bifidobacterium longum subspecies infantis, sono:
- strettamente correlati all’allattamento al seno;
- tra i meglio caratterizzati fra i batteri commensali benefici;
- probiotici, ossia microrganismi in grado di apportare effetti benefici sulla salute dell’ospite.
La loro abbondanza conferisce benefici anche attraverso un’esclusione competitiva con cui sono di ostacolo alla colonizzazione da parte di patogeni. E infatti Escherichia e Bacteroides possono divenire preponderanti se i Bifidobacterium non colonizzano in modo adeguato.
Al contrario, nei bambini allattati artificialmente batteri dei generi Escherichia, come E. coli, Clostridium, come C. difficile, Bacteroides, come B. fragilis e Lactobacillus sono presenti in modo significativamente maggiore rispetto a quanto osservato nei bambini allattati al seno.
Anche se prima dello svezzamento la dieta del neonato allattato al seno è piuttosto costante, il suo microbiota non lo è altrettanto. Si osservano infatti ampie fluttuazioni nell’abbondanza dei taxa batterici, con differenze tra soggetti che riguardano anche i pattern temporali di variazione. Le variazioni osservate potrebbero essere dovute a eventi casuali di colonizzazione, malattie, assunzione di antibiotici, cambiamenti nel comportamento dell’ospite o ad altri aspetti legati allo stile di vita, come anche a differenze nelle risposte immunitarie ai microbi colonizzatori. Ma come questi fattori contribuiscano a plasmare il microbiota intestinale del bambino non è ancora chiaro.
Sembra che anche il viroma si modifichi molto rapidamente dopo la nascita, in quanto la maggior parte delle sequenze virali presenti nella prima settimana di vita non si ritrova dopo la seconda, e il repertorio si espande rapidamente in diversità e numero nel corso dei primi tre mesi. E questo contrasta con la stabilità che si osserva nell’adulto dove il 95% delle sequenze si conserva nel tempo.
In condizioni normali, verso la fine del primo anno di vita, il neonato è stato esposto a una dieta complessa per un periodo significativo e dovrebbe aver sviluppato una comunità microbica con caratteristiche analoghe a quelle del microbiota intestinale adulto, quali:
- una composizione più stabile, filogeneticamente più complessa, e progressivamente più simile tra soggetti diversi;
- una preponderanze di Bacteroidetes e Firmicutes, una comune presenza di Verrucomicrobia e un’abbondanza molto bassa di Proteobacteria;
- un aumento del carico batterico come dei livelli di acidi grassi a catena corta o SCFA, principalmente l’acido acetico, l’acido propionico e l’acido butirrico, nelle feci;
- un aumento dei geni associati all’utilizzo dei carboidrati, alla biosintesi delle vitamine e alla degradazione degli xenobiotici.
Interessante notare che il significativo turn-over di taxa che si verifica dalla nascita al termine del primo anno è accompagnato da una notevole costanza nelle capacità funzionali complessive.
Verso la fine del primo anno di vita anche i colonizzatori virali sono oramai stati sostituiti da virus specifici del bambino.
Verso i due anni e mezzo di vita il microbiota intestinale raggiunge un suo equilibrio, somigliando in modo completo a quello dell’adulto.
La selezione dei batteri più altamente adattati è conseguenza di vari fattori.
- Il passaggio a una dieta solida.
- Una maggiore idoneità all’ambiente intestinale dei taxa che tipicamente dominano il microbiota colonico adulto rispetto agli opportunisti iniziali.
- I cambiamenti progressivi nell’ambiente intestinale, dovuti ai cambiamenti legati allo sviluppo della mucosa stessa.
- Gli effetti del microbiota medesimo.
Quindi i primi 2-3 anni di vita sono il periodo più critico in cui intervenire al fine di ottenere il miglior microbiota possibile così da ottimizzare la crescita e lo sviluppo del bambino.
Tutto questo, partendo da un inizio caotico, porta alla costituzione dell’ecosistema intestinale tipico del giovane adulto, che è relativamente stabile nel tempo, comprese le componenti virale, eucariotica e gli Archeobatteri, sino alla vecchiaia, dominato almeno nella popolazione occidentale da specie dei phyla Firmicutes, che rappresentano circa il 60% della comunità batterica intestinale, Bacteroidetes e Actinobacteria, principalmente con il genere Bifidobacterium, ognuno circa il 10% della comunità batterica, seguiti da Proteobacteria e Verrucomicrobia. I generi Bacteroides, Clostridium, Faecalibacterium, Ruminococcus ed Eubacterium, costituiscono, assieme a Methanobrevibacter smithii, la grande maggioranza della comunità batterica intestinale dell’adulto.
Risultati contrastanti con i dati esposti stanno emergendo dall’analisi di popolazioni ad esempio di villaggi rurali dell’Africa, come visto sopra.
E il microbiota intestinale è sufficientemente simile tra gli individui da permettere l’individuazione di un nucleo microbiomico condiviso.
La stabilità e resilienza è però soggetta a numerose variabili tra cui, come detto, la dieta sembra essere una delle più importanti, variabili che quindi dovranno essere mantenute costanti, o nel caso della malattie evitate, ad esempio attraverso le vaccinazioni, al fine di mantenere la stabilità del microbiota. Va comunque sottolineato che stabilità e resilienza potrebbero essere dannose nel caso in cui la comunità intestinale dominante sia patogena.
Negli anziani, come già visto nei neonati, il microbiota intestinale va incontro a sostanziali cambiamenti. In uno studio condotto in Irlanda su 161 persone sane di 65 o più anni, nella maggior parte dei soggetti il microbiota intestinale è distinto da quello degli adulti più giovani, con una composizione che sembra essere dominato dai phyla Bacteroidetes, i principali, seguiti dai Firmicutes, con percentuali quasi inverse rispetto a quelle trovate negli adulti più giovani, anche se sono state osservate notevoli variazioni tra i soggetti. E tra i generi più abbondanti si trovano Faecalibacterium, che rappresenta circa il 6% dei 15 generi principali, seguiti dalle specie dei generi Ruminococcus, Roseburia e Bifidobacterium, quest’ultimo intorno allo 0,4%.
Anche la variabilità nella composizione delle comunità è più grande rispetto ai giovani adulti, il che potrebbe essere dovuto alla maggior morbilità associata con l’età, e quindi il successivo utilizzo di medicinali, nonché a variazioni della dieta.
Bibliografia
- Breitbart M., Haynes M., Kelley S., Angly F., Edwards R.A., Felts B., Mahaffy J.M., Mueller J., Nulton J., Rayhawk S., Rodriguez-Brito B., Salamon P., Rohwer F. Viral diversity and dynamics in an infant gut. Res Microbiol 2008;159:367-373. doi:10.1016/j.resmic.2008.04.006
- Claesson M.J., Cusack S., O’Sullivan O., Greene-Diniz R., de Weerd H., Flannery E., Marchesi J.R., Falush D., Dinan T., Fitzgerald G., et al. Composition, variability, and temporal stability of the intestinal microbiota of the elderly. Proc Natl Acad Sci USA 2011;108(Suppl 1);4586-4591. doi:10.1073/pnas.1000097107
- Clemente J.C., Ursell L.K., Wegener Parfrey L., and Knight R. The impact of the gut microbiota on human health: an integrative view. Cell 2012;148:1258-1270. doi:10.1016/j.cell.2012.01.035
- De Filippo c., Cavalieri D., Di Paola M., Ramazzotti M., Poullet J.B., Massart S., Collini S., Pieraccini G., and Lionetti P. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci 2010;107(33):14691-14696. doi:10.1073/pnas.1005963107
- Dominguez-Bello M.G., Costello E.K., Contreras M., Magris M., Hidalgo G., Fierer N., and Knight R. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc Natl Acad Sci 2010;107:11971-11975. doi:10.1073/pnas.1002601107
- Fernández L., Langa S., Martín V., Maldonado A., Jiménez E., Martín R., Rodríguez J.M. The human milk microbiota: origin and potential roles in health and disease. Pharmacol Res 2013;69(1):1-10. doi:10.1073/pnas.1002601107
- Huurre A., Kalliomäki M., Rautava S., Rinne M., Salminen S., and Isolauri E. Mode of delivery-effects on gut microbiota and humoral immunity. Neonatology 2008;93:236-240. doi:10.1159/000111102
- Koenig J.E., Spor A., Scalfone N., Fricker A.D., Stombaugh J., Knight R., Angenent L.T., and Ley R.E. Succession of microbial consortia in the developing infant gut microbiome. Proc Natl Acad Sci 2011;108(1):4578-4585. doi:10.1073/pnas.1000081107
- Ley R.E., Peterson D.A., and Gordon J.I. Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell 2006;124(4):837-848. doi:10.1016/j.cell.2006.02.017
- Minot S., Sinha R., Chen J., Li H., Keilbaugh S.A., Wu G.D., Lewis J.D., and Bushman F.D. The human gut virome: inter-individual variation and dynamic response to diet. Genome Res 2011;21:1616-1625. doi:10.1101/gr.122705.111
- Moreno-Indias I.M., Cardona F., Tinahones F.J. and Queipo-Ortuño M.I. Impact of the gut microbiota on the development of obesity and type 2 diabetes mellitus. Front Microbiol 2014;5(190):1-10. doi:10.3389/fmicb.2014.00190
- Newburg D.S. & Morelli L. Human milk and infant intestinal mucosal glycans guide succession of the neonatal intestinal microbiota. Pediatr Res 2015;77:115-120. doi:10.1038/pr.2014.178
- Palmer C., Bik E.M., DiGiulio D.B., Relman D.A., and Brown P.O. Development of the human infant intestinal microbiota. PLoS Biol 2007;5(7):e177. doi:10.1371/journal.pbio.0050177
- Rodrıguez J.M., Murphy K., Stanton C., Ross R.P., I. Kober O.I., Juge N., Avershina E., Rudi K., Narbad A., Jenmalm M.C., Marchesi J.R. and Collado M.C. The composition of the gut microbiota throughout life, with an emphasis on early life. Microb Ecol Health Dis 2015;26:26050. doi:10.3402/mehd.v26.26050
- Wu G.D., Chen J., Hoffmann C., Bittinger K., Chen Y.Y., Keilbaugh S.A., Bewtra M., Knights D., Walters W.A., Knight R., et al. Linking long-term dietary patterns with gut microbial enterotypes. Science 2011;334:105-108. doi:10.1126/science.1208344