La via del pentoso fosfato, anche detta via del fosfogluconato, è una via metabolica, comune a tutti gli organismi viventi, per il metabolismo ossidativo del glucosio, alternativa alla glicolisi da cui si ramifica a livello del glucosio-6-fosfato (G6P). Ramificandosi dalla glicolisi, è anche detta shunt dell’esoso monofosfato, dove shunt sta per “derivazione” o “smistamento”.
La sua funzione principale è la produzione, in rapporti variabili, di NADPH, un coenzima ridotto, e ribosio-5-fosfato, uno zucchero fosforilato a cinque atomi di carbonio, ovvero un pentoso fosfato, da cui il nome della via.[1]
Dal punto di vista concettuale, nella via del pentoso fosfato è possibile individuare due fasi: la fase ossidativa, nel corso della quale viene prodotto il NADPH, e la fase non ossidativa, nella quale si formano il ribosio-5-fosfato e altri zuccheri fosforilati.[2]
È stato stimato che più del 10% del glucosio è metabolizzato attraverso questa via metabolica che, degno di nota, pur ossidando il monosaccaride non comporta alcuna produzione diretta o consumo di ATP.[3]
In Sintesi: Punti Chiave
- Definizione: via per il metabolismo ossidativo del glucosio, alternativa alla glicolisi, la cui funzione principale è la produzione, in rapporti variabili, di NADPH e ribosio-5-fosfato.
- Destino del NADPH: prodotto nella fase ossidativa, fornisce il potere riducente necessario alle biosintesi riduttive e ai meccanismi di difesa antiossidante.
- Destino del ribosio-5-fosfato: prodotto nella fase non ossidativa, è utilizzato per la sintesi dei nucleotidi e di diversi coenzimi.
- Enzimi chiave: la glucosio-6-fosfato deidrogenasi, regolata dal rapporto NADP+/NADPH, e la transchetolasi, enzima dipendente dalla tiamina pirofosfato.
- Flessibilità metabolica: si adatta alle esigenze cellulari, operando in diverse modalità per privilegiare la produzione di NADPH, di ribosio-5-fosfato o il recupero di carbonio sotto forma di intermedi glicolitici.
Indice
- Cenni storici
- Funzione principale
- Dove avviene la via del pentoso fosfato
- Fase ossidativa della via del pentoso fosfato
- Fase non ossidativa della via del pentoso fosfato
- Fabbisogno cellulare di ribosio-5-fosfato, NADPH e ATP
- Bibliografia
Cenni storici
Le prime evidenze dell’esistenza della via del fosfogluconato emersero negli anni trenta del secolo scorso dagli studi di Otto Warburg, premio Nobel per la Fisiologia o la Medicina nel 1931 per il suo lavoro sul metabolismo cellulare e sugli enzimi respiratori.[4]
Warburg e il suo collaboratore Erwin Christian scoprirono il NADP durante studi sull’ossidazione del glucosio-6-fosfato a 6-fosfogluconato.
Ulteriori indicazioni emersero dall’osservazione che nei tessuti il glucosio continuava a essere metabolizzato anche in presenza di inibitori della glicolisi, quali gli ioni fluoruro e iodoacetato, inibitori rispettivamente dell’enolasi (EC 4.2.1.11) e della gliceraldeide-3-fosfato deidrogenasi (EC 1.2.1.12).[5]
Tuttavia la delucidazione completa della via avvenne solo negli anni cinquanta grazie al lavoro di diversi ricercatori, principalmente Efraim Racker, Bernard Horecker, Frank Dickens e Fritz Lipmann, quest’ultimo vincitore del premio Nobel per la Fisiologia o la Medicina nel 1953 grazie alla scoperta del coenzima A, e non specificamente per la via del pentoso fosfato, sebbene il suo lavoro fosse altamente rilevante nel contesto più ampio del metabolismo intermedio.[6][7]
Funzione principale
La principale funzione della via del pentoso fosfato è la produzione di NADPH e ribosio-5-fosfato.[8]
Il NADPH è necessario per le biosintesi riduttive, quali la sintesi degli acidi grassi, del colesterolo, degli ormoni steroidei e di due amminoacidi non essenziali, prolina e tirosina, rispettivamente dal glutammato e dalla fenilalanina, nonché per la riduzione del glutatione ossidato. In queste reazioni il coenzima ridotto funge da donatore di elettroni, o meglio da donatore di uno ione idruro (:H−), equivalente a un protone e due elettroni.[1][9]
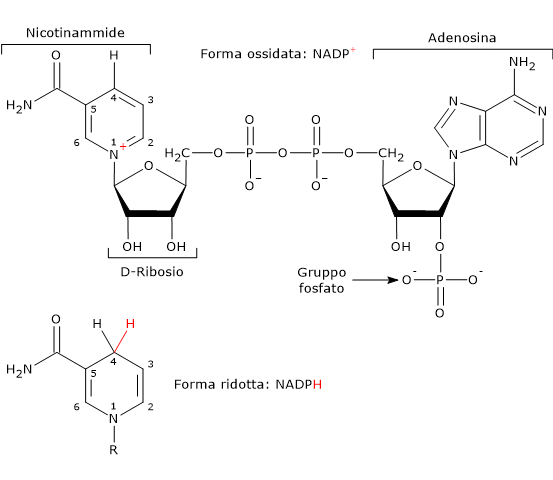
Nota: nei vertebrati circa la metà del NADPH necessario per i passaggi riduttivi della sintesi degli acidi grassi deriva dalla via del pentoso fosfato, mentre la restante parte dalla reazione catalizzata dall’enzima malico (EC 1.1.1.40), di cui di seguito è indicata la reazione.[10]
Malato + NADP+ ⇄ Piruvato + NADPH + CO2
Il ribosio-5-fosfato viene utilizzato nella sintesi dei nucleotidi e degli acidi nucleici, DNA e RNA, dell’ATP, di coenzimi come il coenzima A, il NAD, il NADP e il FAD. Svolge inoltre un ruolo nella biosintesi degli amminoacidi essenziali triptofano e istidina.[8] Lo zucchero fosforilato non viene utilizzato direttamente come tale ma previa conversione, attivazione, a 5-fosforibosil-1-pirofosfato (PRPP) nella reazione catalizzata dalla ribosio fosfato pirofosfochinasi o PRPP sintetasi (EC 2.7.6.1).[10]
Ribosio-5-fosfato + ATP → 5-Fosforibosil-1-pirofosfato + AMP
Funzioni aggiuntive
In aggiunta alla produzione di NADPH e ribosio-5-fosfato, la via del pentoso fosfato ha altre funzioni, sia anaboliche che cataboliche.
In molti batteri e nei lieviti è coinvolta nel catabolismo degli zuccheri a cinque atomi di carbonio ribosio, xilosio e arabinosio.[9]
Nell’uomo contribuisce al catabolismo dei suddetti pentosi e dei meno comuni carboidrati a tre, quattro e sette atomi di carbonio derivanti dalla dieta o da fonti endogene. Questi includono:
- pentosi derivanti dal catabolismo dei carboidrati strutturali;
- ribosio-5-fosfato derivante dal catabolismo dei nucleotidi.[11][12]
Negli organismi fotosintetici contribuisce all’incorporazione dell’anidride carbonica nella molecola del glucosio nel corso del ciclo di Calvin.[9]
Oltre al ribosio 5-fosfato, la via dell’esoso monofosfato fornisce anche diversi intermedi per altri processi biosintetici, tra cui:
- eritrosio-4-fosfato, utilizzato per la sintesi dei tre amminoacidi aromatici triptofano, tirosina e fenilalanina;
- ribulosio-5-fosfato, utilizzato per la sintesi della riboflavina (vitamina B2);
- sedoeptulosio-7-fosfato che, nei batteri Gram-negativi, è utilizzato per la sintesi delle unità di eptosio dello strato lipopolisaccaridico della membrana esterna.[1][13]
Dove avviene la via del pentoso fosfato
Nelle cellule animali e nei batteri la via del pentoso fosfato, come la glicolisi, la sintesi degli acidi grassi, e la maggior parte delle reazioni della gluconeogenesi, avviene nel citosol. Considerando glicolisi, gluconeogenesi e via del pentoso fosfato, è degno di nota affermare che queste vie metaboliche sono interconnesse attraverso diversi enzimi e intermedi.[12]
Nelle cellule vegetali la via del fosfogluconato avviene nei plastidi, e i suoi intermedi raggiungono il citosol attraverso pori di membrana di questi organelli.[10]
Negli esseri umani, l’espressione degli enzimi della via varia significativamente da tessuto a tessuto. Livelli relativamente elevati si ritrovano nel fegato, corteccia surrenale, testicoli, ovaie, tiroide, ghiandole mammarie durante l’allattamento e negli eritrociti.[2] In queste sedi è richiesto un apporto continuo di NADPH per sostenere le biosintesi riduttive e/o contrastare gli effetti dei radicali liberi dell’ossigeno su strutture cellulari sensibili come il DNA, i lipidi di membrana e le proteine. Questa protezione è ottenuta in gran parte attraverso la riduzione del glutatione ossidato (GSSG) a glutatione ridotto (GSH), il principale antiossidante intracellulare negli eritrociti e nella maggior parte delle altre cellule. Questa reazione è catalizzata dalla glutatione reduttasi (EC 1.8.1.7).[14]
Elevati livelli degli enzimi di questa via sono presenti anche in cellule in rapida divisione, quali quelle dell’embrione nelle prime fasi di sviluppo, gli enterociti, le cellule della pelle e del midollo osseo e, in condizioni patologiche, le cellule tumorali. Queste cellule richiedono un apporto continuo di ribosio-5-fosfato per la sintesi dei nucleotidi.
Di contro, nel muscolo scheletrico sono presenti livelli estremamente bassi degli enzimi della via del pentoso fosfato, via che in questa sede è praticamente assente, e dove il glucosio-6-fosfato è utilizzato principalmente per la produzione di energia attraverso la glicolisi e il ciclo dell’acido citrico.[2]
Fase ossidativa della via del pentoso fosfato
La fase ossidativa della via del pentoso fosfato si compone di tre tappe, due ossidazioni irreversibili, la prima e la terza tappa, e una idrolisi.
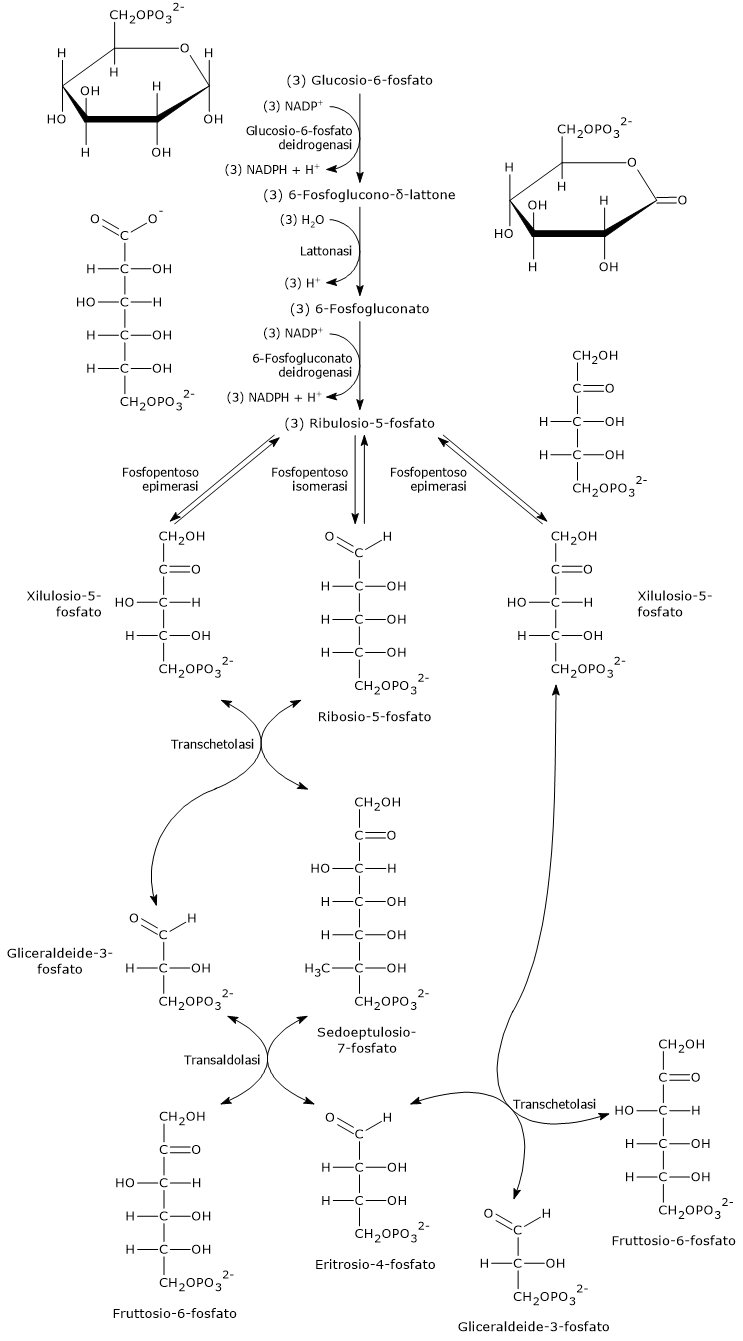
In questa fase una molecola di glucosio-6-fosfato è convertita in una di ribulosio-5-fosfato, uno zucchero fosforilato a 5 atomi di carbonio e substrato di partenza per le reazioni della fase non ossidativa. A questa conversione si affianca la produzione di due molecole di NADPH e il rilascio del carbonio 1 del glucosio in forma di CO2.[15]
L’equazione complessiva è:
3 Glucosio-6-fosfato + 6 NADP+ + 3 H2O → 6 NADPH + 6 H+ + 3 CO2 + 3 Ribulosio-5-fosfato
Ossidazione del glucosio-6-fosfato a 6-fosfoglucono-delta-lattone
Nella prima tappa della fase ossidativa della via del pentoso fosfato, il glucosio-6-fosfato viene ossidato a 6-fosfoglucono-δ-lattone, un estere intramolecolare, reazione catalizzata dalla glucosio-6-fosfato deidrogenasi (G6PD; EC 1.1.1.49).
Nella reazione il NADP+ funge da agente ossidante accettando uno ione idruro dal carbonio 1 del glucosio-6-fosfato, e riducendosi quindi a NADPH.[12]
Glucosio-6-fosfato + NADP+ → 6-Fosfoglucono-δ-lattone + NADPH + H+
Si noti che questa è la prima molecola di NADPH prodotta nella via del pentoso fosfato.
La reazione catalizzata dalla glucosio-6-fosfato deidrogenasi è una reazione esclusiva della via metabolica. Analogamente a quanto accade nella maggior parte delle altre vie metaboliche, la prima reazione esclusiva della via è essenzialmente irreversibile. Nel fegato ha un ΔG di −4,21 kcal/mol (−17,6 kJ/mol), ed è altamente regolata per via allosterica. L’enzima infatti rappresenta il principale punto di controllo del flusso di metaboliti attraverso la via dell’esoso monofosfato.[5]
Espressione della G6PD e funzione immunitaria
Nell’uomo i livelli più elevati di G6PD sono presenti nei neutrofili e macrofagi, due tipi di cellule fagocitarie.
Nel corso dell’infiammazione, queste cellule utilizzano il NADPH per la produzione di radicali superossido (O2−.) dall’ossigeno molecolare nella reazione catalizzata dalla NADPH ossidasi (EC 1.6.3.1).
2 O2 + NADPH → 2 O2•− + NADP+ + H+
I radicali superossido sono utilizzati per la sintesi, a scopi antimicrobici, di altre specie reattive dell’ossigeno (ROS) come anche di radicali liberi dell’azoto (RNS), quali:[2]
- perossido di idrogeno o acqua ossigenata (H2O2), nella reazione catalizzata dalla superossido dismutasi (SOD; EC 1.15.1.1)
2 O2•− + 2 H+ → H2O2 + O2
- perossinitrito (ONOO−), a seguito della reazione con il monossido di azoto (•NO)
O2•− + •NO → O=N–O–O−
- radicale idroperossido (HOO•)
O2•− + H+ → HOO•
Meccanismo catalitico della G6PD
Il meccanismo catalitico dell’enzima è stato studiato nel dettaglio nel microorganismo Leuconostoc mesenteroides, la cui glucosio-6-fosfato deidrogenasi ha la peculiare caratteristica di poter utilizzare come coenzima il NAD+ e/o il NADP+.
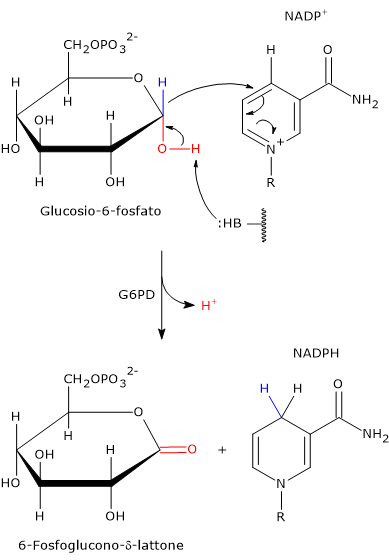
L’enzima non necessita della presenza di ioni metallici per la propria attività. Invece uno dei residui amminoacidici nel sito attivo funge da base generale, ossia è in grado di estrarre un protone dal gruppo ossidrilico consentendo il trasferimento dello ione idruro legato al carbonio 1 del glucosio-6-fosfato al coenzima NADPH+.[16]
Nell’enzima batterico questo è effettuato dall’atomo Nɛ2 dell’anello imidazolico della catena laterale di una istidina. Questo atomo di azoto ha un doppietto elettronico disponibile portare un attacco nucleofilo.
Questo fa sì che il glucosio-6-fosfato, un emiacetale ciclico con il C-1 nello stato di ossidazione aldeidico, sia ossidato a estere ciclico, ossia un lattone. Ciò consente il trasferimento dello ione idruro legato al C-1 del glucosio sul C-4 dell’anello nicotinamidico del NADP+ a dare NADPH.
Poiché questa istidina è conservata in molte delle glucosio-6-fosfato deidrogenasi sequenziate, è probabile che questo meccanismo catalitico sia comune alle G6PD in un’ampia gamma di organismi.[17]
Regolazione della G6PD
La glucosio-6-fosfato deidrogenasi è il principale punto di controllo del flusso metabolico nella via del pentoso fosfato e quindi della produzione di NADPH.[18]
Nell’uomo l’enzima è presente in due forme:
- una monomerica, inattiva;
- una attiva, in equilibrio dimero-tetramero.[14]
Uno dei modulatori della sua attività è il rapporto NADP+/NADPH citosolico.
Il NADPH agisce come inibitore competitivo, mentre il NADP+ è necessario sia per la sua attività catalitica che per mantenere la conformazione attiva, legandosi a un sito regolatore vicino all’interfaccia del dimero e stabilizzandone la struttura.
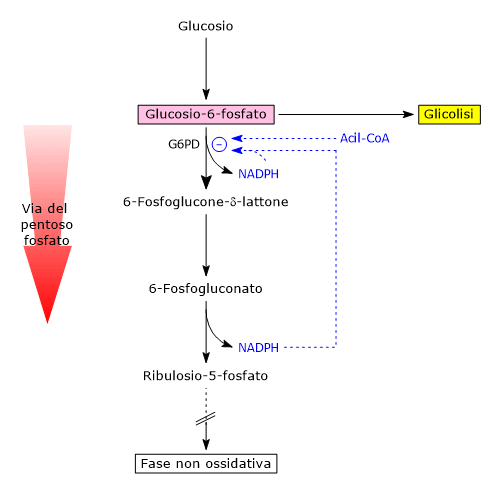
Nelle comuni condizioni metaboliche, il rapporto NADP+/NADPH è basso, meno NADP+ è disponibile per legarsi all’enzima e di conseguenza si riduce la sua attività, a prescindere dai livelli della sua espressione genica. In queste condizioni la fase ossidativa è quasi inattiva.
Se invece si considerano cellule in cui siano particolarmente attive vie metaboliche e/o reazioni che utilizzano NADPH, si verifica la riduzione della sua concentrazione citosolica, un aumento di quella del NADP+ e quindi una stimolazione dell’attività dell’enzima. Ne consegue un’attivazione della fase ossidativa della via dell’esoso monofosfato.
Il destino del glucosio-6-fosfato, intermedio comune a glicolisi e via del pentoso fosfato, dipende quindi anche dal fabbisogno di NADPH.[19][20]
Un secondo meccanismo regolatorio coinvolge l’accumulo di acil-CoA, intermedi nella sintesi degli acidi grassi.[8]
Queste molecole si legano alla forma dimerica dell’enzima, causandone la dissociazione in monomeri inattivi.[14]
L’insulina aumenta l’espressione dei geni per la G6PD e la 6-fosfogluconato deidrogenasi, per cui l’ormone, nello stato ben alimentato, concorre ad aumentare il flusso di carbonio attraverso la via del pentoso fosfato, promuovendo quindi la sintesi di NADPH.
Nota: l’insulina promuove anche la sintesi degli acidi grassi, che dipende da un apporto continuo di NADPH.[15]
Idrolisi del 6-fosfoglucono-delta-lattone a 6-fosfogluconato
Nella seconda tappa della fase ossidativa si verifica l’idrolisi del 6-fosfoglucono-δ-lattone a dare il 6-fosfogluconato, una molecola lineare.
Il 6-fosfoglucono-δ-lattone è di per sé idroliticamente instabile e va incontro a una idrolisi spontanea (non enzimatica) che apre l’anello, reazione che avviene a una velocità significativa. Tuttavia, nella cellula la reazione è notevolmente accelerata dall’azione catalitica della 6-fosfogluconolattonasi (EC 3.1.1.31).[21]
6-Fosfoglucono-δ-lattone + H2O → 6-Fosfogluconato
Decarbossilazione ossidativa del 6-fosfogluconato a ribulosio-5-fosfato
Nella terza e ultima tappa della fase ossidativa si verifica la decarbossilazione ossidativa del 6-fosfogluconato a dare:
- ribulosio-5-fosfato, un cheto pentoso;
- CO2;
- la seconda molecola di NADPH della via.[19]
La reazione è catalizzata dalla 6-fosfogluconato deidrogenasi (EC 1.1.1.44), enzima che richiede la presenza di ioni magnesio.[5]
6-Fosfogluconato + NADP+ → Ribulosio-5-fosfato + NADPH + CO2
Meccanismo catalitico della 6-fosfogluconato deidrogenasi
Il meccanismo catalitico della 6-fosfogluconato deidrogenasi è simile a quello della isocitrato deidrogenasi (EC 1.1.1.41), un enzima del ciclo dell’acido citrico, e consiste in una catalisi acido/base.
La reazione procede attraverso tre passaggi in cui sono coinvolti due residui amminoacidici altamente conservati presenti nel sito attivo, una lisina (Lys) e un glutammato (Glu).[5][22]
Nell’uomo:
- Lys185, che agisce sia come acido generale che come base generale;
- Glu192, che agisce come acido generale.[23]
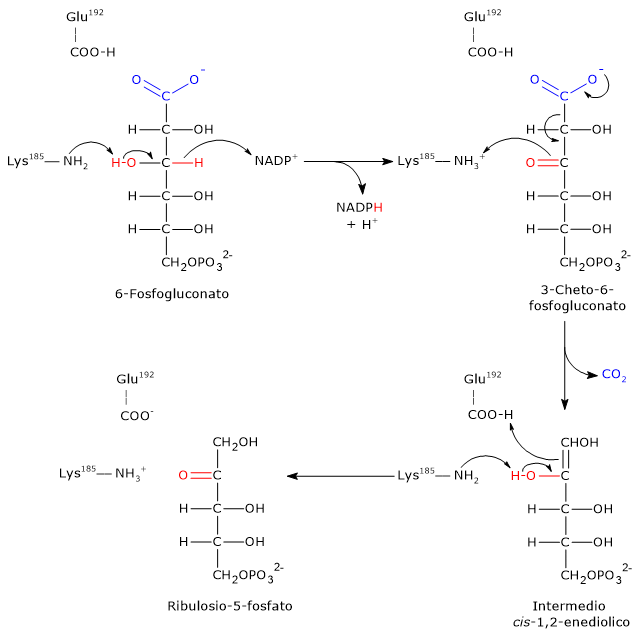
Passaggio 1: ossidazione
Nel primo passaggio il 6-fosfogluconato è ossidato in un β-chetoacido, il 3-cheto-6-fosfogluconato.
- L’ε-amino gruppo della Lys185 funge da base generale, da nucleofilo, estraendo un protone dal gruppo ossidrilico legato sul C-3.
- Segue il trasferimento dello ione idruro (H−) dal C-3 del substrato al C-4 dell’anello nicotinamidico del NADP+.
- In questo modo si viene a formare il 3-cheto intermedio e una molecola di NADPH è rilasciata dal sito attivo.
Passaggio 2: decarbossilazione
Il 3-cheto-6-fosfogluconato formato è altamente instabile e subisce una decarbossilazione spontanea, con conseguente formazione di:
- CO2 (dal C-1 del glucosio 6-fosfato originale);
- intermedio cis-1,2-enediolo del ribulosio 5-fosfato, un tautomero ad alta energia.
In questo passaggio la Lys185 agisce come acido generale, donando un protone all’ossigeno carbonilico legato al C-3, facilitando la decarbossilazione.
Passaggio 3: tautomerizzazione cheto-enolica
Nel passaggio finale, l’intermedio cis-1,2-enediolo subisce una tautomerizzazione cheto-enolica stereospecifica a dare ribulosio 5-fosfato.
- Glu192 dona un protone al C-1 dell’enediolo.
- Contemporaneamente, il gruppo ε-amminico di Lys185 agisce come base, estraendo un protone dal gruppo ossidrilico sul C-2.
Il risultato è la formazione di ribulosio-5-fosfato, completando la fase ossidativa della via del pentoso fosfato.[22][23]
Fase non ossidativa della via del pentoso fosfato
Nella fase non ossidativa della via del pentoso fosfato viene prodotta una varietà di carboidrati fosforilati il cui destino dipende dalle necessità relative di NADPH, ribosio-5-fosfato e ATP da parte della cellula.
Questa fase si compone di cinque tappe facilmente reversibili, nel corso delle quali si verifica una serie di interconversioni di zuccheri fosforilati.
La fase non ossidativa ha inizio con due reazioni a carico del ribulosio-5-fosfato: una isomerizzazione e una epimerizzazione. Suddette reazioni portano alla trasformazione del ribulosio-5-fosfato rispettivamente in:
- ribosio-5-fosfato;
- xilulosio-5-fosfato.[15]
Le epimerasi (EC 5.1), un sottogruppo delle isomerasi, catalizzano l’inversione reversibile della configurazione di un atomo di carbonio asimmetrico, in genere attraverso la rimozione e l’aggiunta di un atomo di idrogeno.
Di contro, nelle reazioni di isomerizzazione lo scambio di gruppi chimici si verifica tra atomi di carbonio.[24]
Nota: le reazioni enzimatiche di isomerizzazione ed epimerizzazione svolgono un ruolo chiave nel metabolismo dei carboidrati consentendo l’interconversione degli zuccheri con proprietà funzionali distinte.[25]
Isomerizzazione del ribulosio-5-fosfato a ribosio-5-fosfato
Nella prima tappa della fase non ossidativa della via del pentoso fosfato, una reazione di isomerizzazione, il ribulosio-5-fosfato, un chetoso, viene convertito nell’aldoso corrispondente, il ribosio-5-fosfato.
La reazione è catalizzata dalla fosfopentoso isomerasi, anche detta ribosio-5-fosfato isomerasi (EC 5.3.1.6).
Ribulosio-5-fosfato ⇄ Ribosio-5-fosfato
Le due molecole sono un esempio di isomeria di gruppo funzionale, in cui un chetone viene convertito in un’aldeide.[1]
Meccanismo catalitico della ribosio-5-fosfato isomerasi
Il meccanismo catalitico della ribosio-5-fosfato isomerasi, simile a quello dell’enzima glicolitico fosfoglucosio isomerasi (EC 5.3.1.9), procede attraverso la formazione dell’intermedio ad alta energia cis-1,2-enediolo del ribulosio-5-fosfato, formazione conseguente a un meccanismo di trasferimento protonico comune alle isomerizzazioni aldoso-chetoso.[26]
Di seguito viene descritto il possibile meccanismo catalitico dell’enzima di Escherichia coli nella direzione della formazione del ribulosio-5-fosfato dal ribosio-5-fosfato, che è anche la direzione seguita nel ciclo di Calvin della fotosintesi.
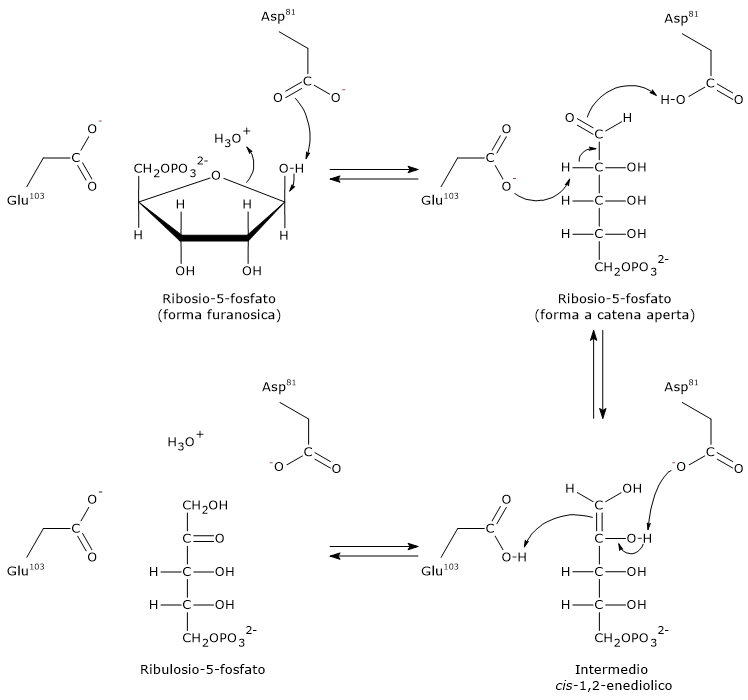
Passaggio 1: apertura dell’anello
Il primo passaggio consiste nell’apertura dell’anello furanosico del ribosio-5-fosfato indotta dall’interazione con un residuo di acido aspartico (Asp81) che accetta un protone dal gruppo idrossilico legato al C-1, mentre è probabile che sia l’acqua il donatore del protone richiesto in questo passaggio.
Nota: in soluzione acquosa, l’apertura spontanea dell’anello del ribosio è rara, meno dello 0,5%.
Passaggio 2: formazione dell’intermedio enediolico
Un residuo di acido glutammico (Glu103) funge da base generale, da nucleofilo, estraendo il protone legato sul C-2, mentre Asp81 dona un protone. Questa azione concertata porta alla formazione dell’intermedio cis-1,2-enediolo.
Passaggio 3: protonazione e formazione del prodotto
La base iniziale, Glu103, adesso protonata, funge da acido generale e dona un protone al C-1 dell’intermedio enediolico, mentre Asp81 agisce da base generale accettando un protone dal gruppo ossidrilico legato al C-2. Il risultato di questi trasferimenti protonici è la formazione del ribulosio-5-fosfato.
Durante la sintesi del ribosio-5-fosfato a partire dal ribulosio-5-fosfato, come avviene nella via del pentoso fosfato, la fosfopentoso isomerasi opera in direzione inversa, seguendo gli stessi principi generali della catalisi acido-base.[27]
Epimerizzazione del ribulosio-5-fosfato a xilulosio-5-fosfato
L’altro destino metabolico del ribulosio-5-fosfato nella via del pentoso fosfato è quello di essere epimerizzato a xilulosio-5-fosfato, un chetoso come il ribulosio-5-fosfato, nella reazione catalizzata dalla fosfopentoso epimerasi (EC 5.1.3.1).[5]
Ribulosio-5-fosfato ⇄ Xilulosio-5-fosfato
Nota: lo xilulosio-5-fosfato agisce anche come molecola regolatrice. Inibisce la gluconeogenesi e stimola la glicolisi modulando la concentrazione intracellulare di fruttosio-2,6-bisfosfato nel fegato.[28]
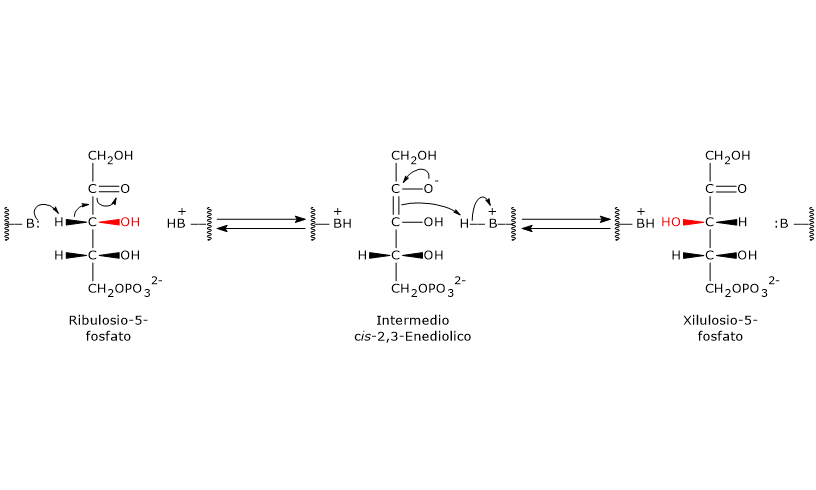
Meccanismo catalitico della fosfopentoso epimerasi
Anche questa reazione, come quelle catalizzate dalla 6-fosfogluconato deidrogenasi e dalla ribosio-5-fosfato isomerasi, procede attraverso la formazione di un intermedio enediolico, ma con il doppio legame non tra i carboni 1 e 2 ma tra quelli 2 e 3.[5]
Nel corso della reazione un residuo amminoacidico presente nel sito attivo dell’enzima agisce da base generale ed estrae un protone dal C-3, il che porta alla formazione dell’intermedio cis-2,3-enediolico.
Di seguito un residuo amminoacidico acido dona un protone al C-3, ma sul lato opposto, determinando così l’inversione della configurazione sul C-3 e la formazione dello xilulosio-5-fosfato.[29]
Arrivati a questo punto la via dell’esoso monofosfato ha portato alla formazione, per ogni molecola di glucosio-6-fosfato metabolizzata, di:
- un pool di tre pentoso-5-fosfati, ossia ribulosio-5-fosfato, ribosio-5-fosfato e xilulosio-5-fosfato, che coesistono all’equilibrio;
- due molecole di NADPH.
Nelle tre tappe successive, dalla sesta all’ottava, la transchetolasi (EC 2.2.1.1) e la transaldolasi (EC 2.2.1.2), enzimi chiave della via del pentoso fosfato, catalizzano una serie di riarrangiamenti degli scheletri carboniosi.
Queste reazioni portano alla formazione di unità carboniose a tre, quattro, sei e sette atomi che potranno essere utilizzate per vari scopi metabolici, a seconda delle necessità della cellula.[12]
In termini di analisi dei flussi di metaboliti tra le differenti vie metaboliche, l’azione concertata della transchetolasi e della transaldolasi permette l’interazione della via del pentoso fosfato, in particolare la sua fase non ossidativa, con:
- glicolisi;
- gluconeogenesi;
- vie che portano alla formazione di numerose vitamine, coenzimi e precursori degli acidi nucleici.[1]
Transchetolasi
La transchetolasi è l’enzima limitante la velocità della fase non ossidativa della via del pentoso fosfato, e il primo enzima che agisce a valle della ribosio-5-fosfato isomerasi e della fosfopentoso epimerasi.[30]
Scoperta indipendentemente nel 1953 da Horecker e Racker, e così chiamata da Racker, catalizza, nella sesta e ottava tappa, il trasferimento di unità a due atomi di carbonio da un donatore chetoso a un accettore aldoso.
I donatori chetosi sono tipicamente:
- xilulosio-5-fosfato;
- sedoeptulosio-7-fosfato;
- fruttosio-6-fosfato.
Gli accettori aldosi includono:
- ribosio-5-fosfato;
- gliceraldeide-3-fosfato;
- eritrosio-4-fosfato.[7]
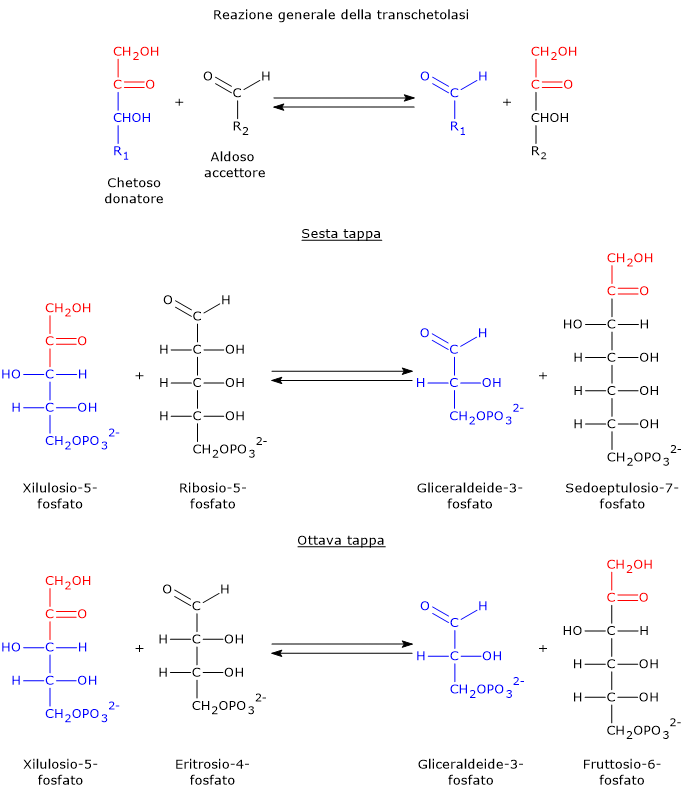
Prendendo come esempio le reazioni in avanti, nella sesta tappa il donatore chetoso xilulosio-5-fosfato trasferisce un’unità a due atomi di carbonio all’accettore aldoso ribosio-5-fosfato. Questa reazione genera gliceraldeide-3-fosfato, che corrisponde al residuo rimanente a tre atomi di carbonio dello xilulosio-5-fosfato, e sedoeptulosio-7-fosfato, uno zucchero a sette atomi di carbonio che sarà utilizzato nella tappa successiva, la settima.[31]
Nell’ottava tappa il chetoso donatore è lo xilulosio-5-fosfato mentre l’aldoso accettore è l’eritrosio-4-fosfato, a dare una seconda molecola di gliceraldeide-3-fosfato e una di fruttosio-6-fosfato.
Da notare che tre dei quattro prodotti delle reazioni catalizzate dalla transchetolasi, due molecole di gliceraldeide-3-fosfato e una di fruttosio-6-fosfato, sono anche intermedi della glicolisi.[30]
La transchetolasi può utilizzare come substrati, oltre allo xilulosio-5-fosfato, al sedoeptulosio-7-fosfato e al fruttosio-6-fosfato anche altri 2-chetozuccheri, nonché diversi altri aldoso fosfati.[32]
La transchetolasi richiede la tiamina pirofosfato (TPP) come cofattore. TPP, forma biologicamente attiva della tiamina (vitamina B1), è strettamente legata all’enzima e partecipa al trasferimento di intermedi aldeidici attivati stabilizzando i carbanioni a due atomi di carbonio formati durante la reazione.[8]
Meccanismo catalitico della transchetolasi
L’atomo di carbonio compreso tra l’atomo di zolfo e quello di azoto dell’anello tiazolico della tiamina pirofosfato, ossia l’atomo C-2, è molto più acido rispetto alla maggior parte dei gruppi =CH presenti in altre molecole. Questo è dovuto all’atomo di azoto caricato positivamente adiacente, che stabilizza elettrostaticamente il carbanione derivante dalla dissociazione del protone. Questo fa sì che l’atomo di idrogeno a esso legato sia facilmente dissociabile a formare un carbanione. L’estrazione del protone è catalizzata dalla transchetolasi.
Il carbanione risultante reagisce con il carbonio carbonilico del substrato chetonico, nella tappa 6 lo xilulosio-5-fosfato o il sedoeptulosio-7-fosfato nella reazione in direzione opposta, oppure, considerando la tappa 8, di nuovo lo xilulosio-5-fosfato o il fruttosio-6-fosfato nella reazione in direzione opposta.
Prendendo come esempio la reazione in avanti della tappa 6, il composto di addizione tra la tiamina pirofosfato e lo xilulosio-5-fosfato va incontro a frammentazione a seguito della scissione del legame C2–C3 dello xilulosio-5-fosfato. Questa reazione produce gliceraldeide-3-fosfato, che è rilasciata, e un’unità a due atomi di carbonio, un gruppo idrossietilico con carica negativa, che rimane legato al C-2 dell’anello tiazolico.
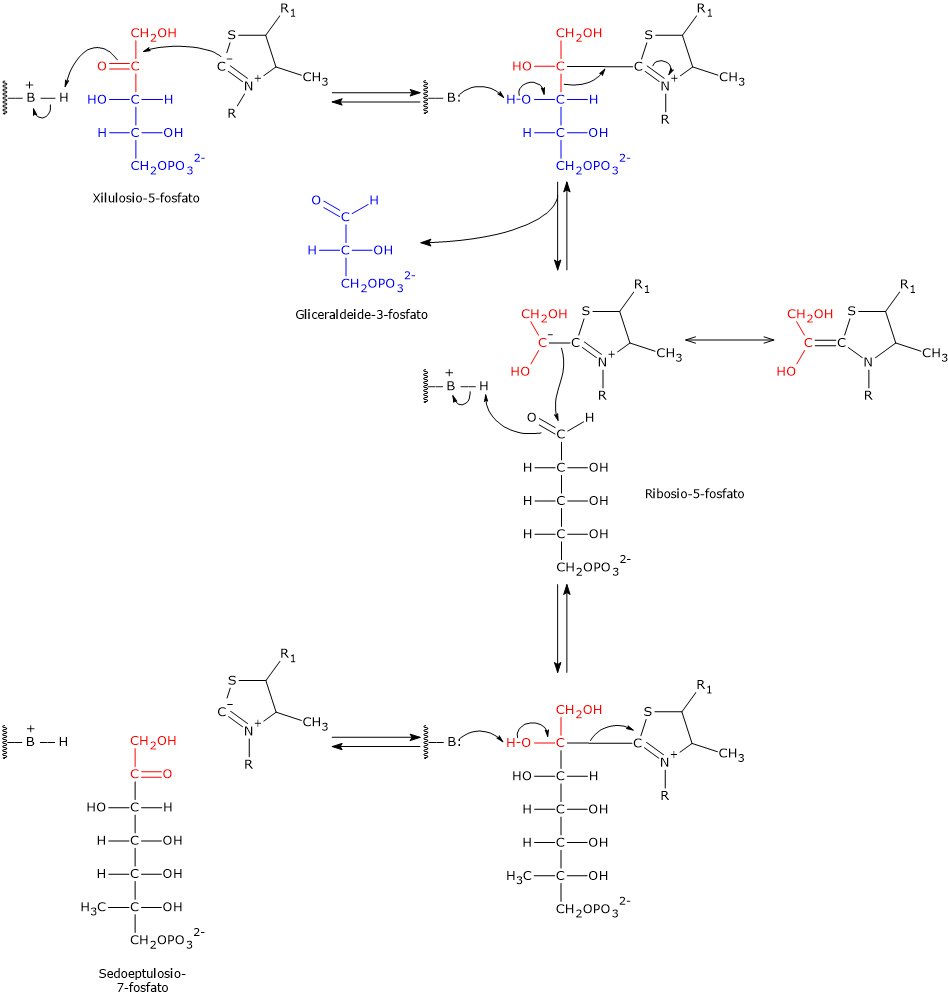
La carica negativa presente sull’intermedio idrossietilico viene stabilizzata dall’anello tiazolico della TPP grazie alla presenza dell’atomo di azoto carico positivamente che funge da trappola o pozzo per gli elettroni. Quindi l’anello tiazolico fornisce una struttura elettron-deficiente o elettrofila nella quale gli elettroni del carbanione possono delocalizzarsi per risonanza.
Nell’ultimo passaggio si verifica la condensazione tra il gruppo idrossietilico-TPP e il ribosio-5-fosfato, l’aldeide accettrice, attraverso l’attacco nucleofilo del carbanione sul carbonio aldeidico del ribosio-5-fosfato, a formare un addotto covalente legato alla tiamina pirofosfato.
La successiva scissione dell’addotto porta alla liberazione di sedoeptulosio-7-fosfato, rigenerando il carbanione della tiamina pirofosfato.[8][12][30]
Transaldolasi
La transaldolasi fu scoperta nel 1953 da Horecker e Smyrniotis nel lievito Saccharomyces cerevisiae. L’enzima interviene nella settima tappa della via del pentoso fosfato, dove catalizza il trasferimento di una unità a tre atomi di carbonio da un substrato donatore, il sedoeptulosio-7-fosfato, a un substrato accettore, la gliceraldeide-3-fosfato, a dare fruttosio-6-fosfato ed eritrosio-4-fosfato.
Sedoeptulosio-7-fosfato + Gliceraldeide-3-fosfato ⇄ Fruttosio-6-fosfato + Eritrosio-4-fosfato
In analogia con quanto visto per le reazioni catalizzate dalla transchetolasi, anche in questo caso il donatore dell’unità carboniosa trasferita è un chetoso mentre l’accettore è un aldoso.
Nella reazione in direzione opposta il chetoso donatore sarà il fruttosio-6-fosfato mentre l’aldoso accettore l’eritrosio-4-fosfato.[9]
Meccanismo catalitico della transaldolasi
A differenza della transchetolasi, la transaldolasi non necessita per la propria attività della presenza di un cofattore.
La reazione si compone di una parte equivalente a una scissione aldolica seguita da una equivalente a una condensazione aldolica. Di seguito verrà analizzato il meccanismo catalitico della transaldolasi B di E. coli, considerando la reazione nella direzione della formazione dell’eritrosio-4-fosfato e del fruttosio-6-fosfato.
Passaggio 1: scissione aldolica e formazione dell’intermedio
Nel primo passaggio l’ε-ammino gruppo della catena laterale di un residuo di lisina (Lys132) nel sito attivo, a seguito del trasferimento di un protone a un residuo di acido glutammico (Glu96), trasferimento mediato da una molecola d’acqua, porta un attacco nucleofilo al C-2 del sedoeptulosio-7-fosfato, il carbonio carbonilico. Il risultato è la formazione di una carbinolammina con il sedoeptulosio-7-fosfato.
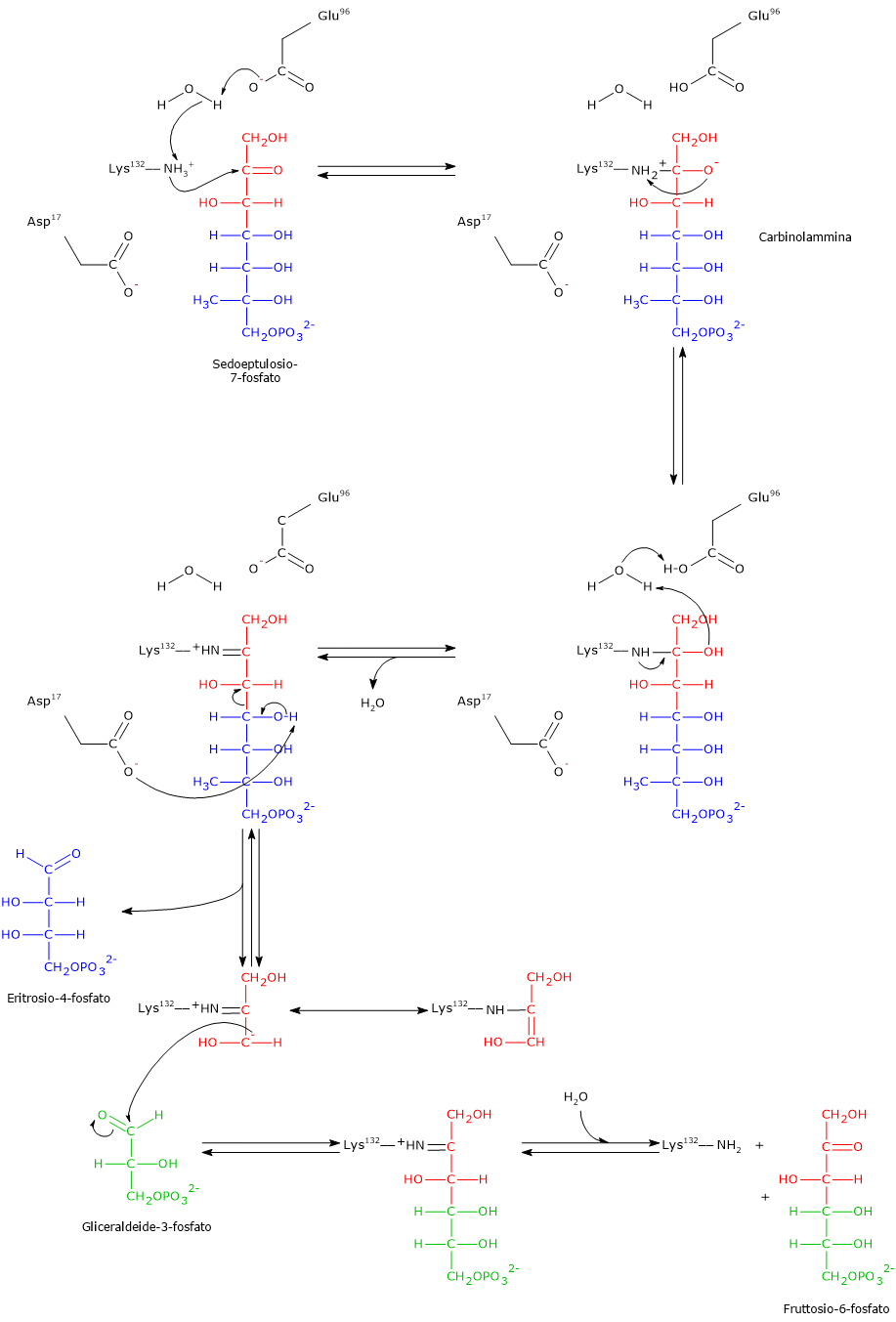
Segue la perdita di una molecola d’acqua dalla carbinolammina con formazione di una immina, o base di Schiff, legata all’enzima. Anche in questo passaggio interviene il trasferimento di un protone da Glu96 alla molecola d’acqua catalitica.
Nota: l’intermedio covalente enzima–substrato è simile a quello che si forma nella reazione catalizzata dalla aldolasi (EC 4.1.2.13) nella quarta tappa della glicolisi.
Di seguito, il gruppo carbossilico di un residuo di acido aspartico (Asp17) agisce come base ed estrae un protone dal gruppo idrossilico legato sul C-4. Questo facilita la rottura del legame covalente tra C-3 e C-4, una scissione aldolica che porta alla liberazione dell’aldoso eritrosio-4-fosfato, il primo prodotto della reazione. Rimane invece legato all’enzima un carbanione a tre atomi di carbonio che è stabilizzato per delocalizzazione (tramite base di Schiff), analogamente a quanto visto per la transchetolasi. Infatti, al pari dell’atomo di azoto dell’anello tiazolico della tiamina pirofosfato, anche l’atomo di azoto con carica positiva della base di Schiff agisce da trappola per gli elettroni stabilizzando la carica negativa del carbanione.[5][8][12][33]
Passaggio 2: condensazione aldolica e rilascio del prodotto
Dopo il rilascio dell’eritrosio-4-fosfato, il substrato accettore gliceraldeide-3-fosfato entra nel sito attivo.
Il carbanione precedentemente formato compie un attacco nucleofilo al carbonio carbonilico della gliceraldeide-3-fosfato. Questa condensazione aldolica porta alla formazione di un nuovo legame carbonio–carbonio e di un intermedio chetosico legato covalentemente.
L’ultimo passaggio prevede l’idrolisi della base di Schiff. Questa reazione ripristina il gruppo ε-amminico libero della Lys132 e rilascia il fruttosio-6-fosfato, un chetoso e il secondo prodotto della reazione. L’enzima risulta così rigenerato e pronto per un nuovo ciclo catalitico.
Come già menzionato, nell’ottavo passaggio della via del pentoso fosfato, la transchetolasi catalizza la sintesi di fruttosio-6-fosfato e gliceraldeide-3-fosfato a partire da eritrosio-4-fosfato e xilulosio-5-fosfato, collegando l’attività della transaldolasi e della transchetolasi nella fase non ossidativa della via metabolica.[33]
Fabbisogno cellulare di ribosio-5-fosfato, NADPH e ATP
Dal punto di vista molecolare il destino del glucosio-6-fosfato dipende in larga parte dalle attività relative degli enzimi che lo metabolizzano nella via glicolitica e nella via del pentoso fosfato, in particolare dalla fosfofruttochinasi-1 (PFK-1; EC 2.7.1.11) e la glucosio-6-fosfato deidrogenasi, enzimi la cui attività è altamente regolata.[1]
PFK-1 è inibita quando aumenta la concentrazione dell’ATP e/o di citrato, ossia quando la carica energetica della cellula è alta. Di contro è attivata quando aumenta la concentrazione dell’AMP e/o del fruttosio-2,6-bisfosfato, ossia quando la carica energetica della cellula è bassa. Ne consegue che, quando la carica energetica della cellula è alta il flusso di carbonio, e quindi di glucosio-6-fosfato, attraverso la glicolisi si riduce.[34][35]
G6PD è invece inibita dal NADPH e dagli acil-CoA, intermedi nella biosintesi degli acidi grassi. Se quindi la concentrazione citosolica del NADPH aumenta il flusso di glucosio-6-fosfato attraverso la via del pentoso fosfato è inibito. Viceversa, se i livelli di NADPH cadono, l’inibizione viene meno, la via si riattiva e vengono sintetizzati sia NADPH che ribosio-5-fosfato.[8][19]
Pertanto, in base alle necessità cellulari di NADPH, ribosio-5-fosfato e ATP, quello che accadrà è una combinazione di alcune reazioni della via glicolitica, della gluconeogenesi e della via del pentoso fosfato al fine di sintetizzare i metaboliti richiesti, sfruttando anche il fatto che la fase non ossidativa dello shunt dell’esoso monofosfato è controllata essenzialmente dalla disponibilità dei substrati.
Di seguito sono analizzate le quattro principali possibilità.[12]
Fabbisogno di NADPH molto maggiore di quello di ribosio-5-fosfato e ATP
Quando il fabbisogno cellulare di NADPH è molto maggiore di quello di ribosio-5-fosfato o ATP, ossia quando la cellula non ha bisogno di ulteriore produzione di ATP e la carica energetica è alta, il glucosio-6-fosfato entra nella via del pentoso fosfato e può essere completamente ossidato a CO2. Una condizione metabolica del genere si ritrova ad esempio nel tessuto adiposo nel corso di una intensa sintesi di acidi grassi.
Nella fase ossidativa della via, per ogni molecola di glucosio-6-fosfato ossidata a ribulosio-5-fosfato, sono prodotte due molecole di NADPH. Attraverso una combinazione delle reazioni della fase non ossidativa e di alcune reazioni della gluconeogenesi, nello specifico quelle catalizzate dagli enzimi trioso fosfato isomerasi (EC 5.3.1.1), aldolasi (EC 4.1.2.13), fosfoglucosio isomerasi (EC 5.3.1.9), e fruttosio-1,6-bisfosfatasi (EC 3.1.3.11), sei molecole di ribulosio-5-fosfato vengono convertite in cinque di glucosio-6-fosfato. È quindi anche possibile affermare che le reazioni della fase non ossidativa permettono alle reazioni della fase ossidativa di procedere tramite il reintegro del substrato di partenza.
In questo processo è possibile individuare tre gruppi di reazioni che operano in sequenza.
- Reazioni della fase ossidativa
Queste reazioni sono catalizzate dagli enzimi della fase ossidativa, e si ha la formazione di due molecole di NADPH e una di ribulosio-5-fosfato per molecola di glucosio-6-fosfato.
6 Glucosio-6-fosfato + 12 NADP+ + 6 H2O → 6 Ribulosio-5-fosfato + 6 CO2 + 12 NADPH + 12 H+
- Reazioni della fase non ossidativa
Al secondo gruppo appartengono le reazioni catalizzate dagli enzimi fosfopentoso epimerasi, ribosio-5-fosfato isomerasi, transchetolasi e transaldolasi, ossia quelli della fase non ossidativa della via, che portano alla conversione del ribulosio-5-fosfato in fruttosio-6-fosfato e gliceraldeide-3-fosfato.
6 Ribulosio-5-fosfato → 4 Fruttosio-6-fosfato + 2 Gliceraldeide-3-fosfato
- Reazioni glucogeniche
Il fruttosio-6-fosfato e la gliceraldeide3-fosfato prodotti nella fase non ossidativa vengono riciclati in glucosio 6-fosfato tramite reazioni gluconeogeniche. Queste reazioni permettono al ciclo di ricominciare.
4 Fruttosio-6-fosfato + 2 Gliceraldeide-3-fosfato + H2O → 5 Glucosio-6-fosfato + Pi
Sommando le ultime due reazioni si evince che sei molecole di ribulosio-5-fosfato sono convertite in cinque di glucosio-6-fosfato.
6 Ribulosio-5-fosfato + H2O → 5 Glucosio-6-fosfato + Pi
Dalla somma delle reazioni del primo, secondo e terzo gruppo si ottiene la reazione complessiva:
Glucosio-6-fosfato + 12 NADP+ + 7 H2O → 6 CO2 + 12 NADPH + 12 H+ + Pi
Dunque, una molecola di glucosio-6-fosfato, attraverso sei cicli della via del pentoso fosfato, accoppiati con alcune reazioni della reazioni gluconeogenesi, è ossidato a 6 molecole di CO2, con la concomitante produzione di dodici molecole di NADPH, ma nessuna produzione netta di ribosio-5-fosfato.[5][8][12]
Fabbisogno di NADPH e ATP molto maggiore di quello di ribosio-5-fosfato
Quando il fabbisogno cellulare di NADPH è molto maggiore di quello di ribosio-5-fosfato e la carica energetica della cellula è bassa, ossia la cellula necessita di ATP, il ribulosio-5-fosfato prodotto nella fase ossidativa della via del pentoso fosfato viene convertito in fruttosio-6-fosfato e gliceraldeide-3-fosfato attraverso le reazioni della fase non ossidativa. Di seguito i due intermedi, attraverso le reazioni della glicolisi, sono ossidati a piruvato, la base coniugata dell’acido piruvico, con concomitante produzione di ATP.
La reazione complessiva è:
3 Glucosio-6-fosfato + 6 NADP+ + 5 NAD+ + 5 Pi + 8 ADP → 5 Piruvato + 3 CO2 + 6 NADPH + 5 NADH + 8 ATP + 2 H2O + 8 H+
Se la cellula necessita di altro ATP, il piruvato prodotto potrà essere ossidato attraverso il ciclo dell’acido citrico. Se invece non è necessario produrre ulteriore ATP, il piruvato potrà essere utilizzato come precursore in diverse vie biosintetiche.
Da notare che anche in questo caso, come nel precedente, non si verifica alcuna produzione netta di ribosio-5-fosfato.[5][8][12]
Fabbisogno di ribosio-5-fosfato molto maggiore di quello di NADPH
Quando il fabbisogno di ribosio-5-fosfato è molto maggiore rispetto a quello di NADPH, come nelle cellule che si dividono rapidamente, nelle quali è quindi in corso una rapida sintesi di nucleotidi, precursori del DNA, le reazioni della fase ossidativa della via del pentoso fosfato sono by-passate, e non vi è sintesi di NADPH. Al contrario, poiché le reazioni della fase non ossidativa sono facilmente reversibili, la riduzione della concentrazione del ribosio-5-fosfato, causata dal suo rapido utilizzo, avrà come effetto quello di stimolarne la sintesi.
In questo contesto metabolico ciò che accade è che, attraverso la via glicolitica, molto del glucosio-6-fosfato viene convertito in fruttosio-6-fosfato e gliceraldeide-3-fosfato. Questi intermedi sono quindi utilizzati dalla transaldolasi e transchetolasi a dare ribosio-5-fosfato e xilulosio-5-fosfato. Quest’ultimo, attraverso le reazioni catalizzate dalla fosfopentoso epimerasi, e successivamente dalla ribosio-5-fosfato isomerasi, è convertito in ribosio-5-fosfato.
La reazione complessiva è:
6 Glucosio-6-fosfato + ATP → 6 Ribosio-5-fosfato + ADP + H+
In queste condizioni metaboliche quello che si verifica è una combinazione di reazioni della glicolisi e della fase non ossidativa della via del fosfogluconato, con queste ultime nella direzione della sintesi del ribosio-5-fosfato.
Da notare che in questo caso nessun metabolita torna alla glicolisi.[5][8][12]
I fabbisogni di ribosio-5-fosfato e NADPH si equivalgono
Se una molecola di ribosio-5-fosfato e due molecole di NADPH per molecola di glucosio-6-fosfato metabolizzata sono sufficienti a soddisfare le necessità metaboliche della cellula, le reazioni predominanti sono quelle della fase ossidativa più la reazione catalizzata dalla ribosio-5-fosfato isomerasi.
La reazione complessiva è:
Glucosio-6-fosfato + 2 NADP+ + H2O → Ribosio-5-fosfato + 2 NADPH + 2 H+ + CO2
Anche in questa condizione metabolica nessun metabolita torna alla glicolisi.[5][8][12]
| Scenario | Via predominante | Principale prodotto | Note |
|---|---|---|---|
| Alta richiesta di NADPH, bassa necessità di ribosio-5-P o ATP | Fase ossidativa completa + riciclo glucogenico | ↑ NADPH (12 per G6P), CO2 (6), nessun ribosio-5-P netto | Sostiene la sintesi degli acidi grassi (ad es., nel tessuto adiposo) |
| Alta richiesta di NADPH e ATP, bassa necessità di ribosio-5-P | Fase ossidativa + glicolisi | NADPH (6), ATP (8), piruvato (5), NADH (5), CO2 (3) | Sostiene sia la biosintesi che la produzione di energia |
| Alta richiesta di ribosio-5-P, bassa necessità di NADPH | Fase non ossidativa da intermedi glicolitici | Ribosio-5-P (6 per 6 G6P), consumo di ATP | Presente in cellule in rapida divisione (ad es., tumori, midollo osseo) |
| Richiesta bilanciata di ribosio-5-P e NADPH | Fase ossidativa + ribosio-5-P isomerasi | Ribosio-5-P (1), NADPH (2), CO2; nessun ritorno netto alla glicolisi | Tipico di una domanda anabolica equilibrata |
Bibliografia
- ^ a b c d e f Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 8th Edition. W.H. Freeman and Company, 2021.
- ^ a b c d Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley & Sons, 2009.
- ^ Gebril H.M., Avula B., Wang Y.H., Khan I.A., Jekabsons M.B. (13)C metabolic flux analysis in neurons utilizing a model that accounts for hexose phosphate recycling within the pentose phosphate pathway. Neurochem Int 2016;93:26-39. doi:10.1016/j.neuint.2015.12.008
- ^ Otto Warburg – Nobel Lecture. NobelPrize.org. Nobel Prize Outreach 2025. Sun. 3 Aug 2025. https://www.nobelprize.org/prizes/medicine/1931/warburg/lecture/
- ^ a b c d e f g h i j k Heilman D., Woski S., Voet D., Voet J.G., Pratt C.W. Fundamentals of biochemistry: life at the molecular level. 6th Edition. Wiley, 2023.
- ^ Fritz Lipmann – Nobel Lecture. NobelPrize.org. Nobel Prize Outreach 2025. Sun. 3 Aug 2025. https://www.nobelprize.org/prizes/medicine/1953/lipmann/lecture/
- ^ a b Horecker B.L. The pentose phosphate pathway. J Biol Chem 2002;277(50):47965-47971. doi:10.1074/jbc.X200007200
- ^ a b c d e f g h i j k Garrett R.H., Grisham C.M. Biochemistry. 7th Edition. Cengage Learning, 2023.
- ^ a b c d Samland A.K., Sprenger G.A. Transaldolase: from biochemistry to human disease. Int J Biochem Cell Biol 2009;41(7):1482-1494. doi:10.1016/j.biocel.2009.02.001
- ^ a b c Michal G., Schomburg D. Biochemical pathways. An atlas of biochemistry and molecular biology. 2nd Edition. John Wiley & Sons, 2012.
- ^ Stincone A., Prigione A., Cramer T., Wamelink M.M., Campbell K., Cheung E., Olin-Sandoval V., Grüning N.M., Krüger A., Tauqeer Alam M., Keller M.A., Breitenbach M., Brindle K.M., Rabinowitz J.D., Ralser M. The return of metabolism: biochemistry and physiology of the pentose phosphate pathway. Biol Rev Camb Philos Soc 2015;90(3):927-63. doi:10.1111/brv.12140
- ^ a b c d e f g h i j k Berg J.M., Tymoczko J.L., Gregory J.G. Jr., Stryer L. Biochemistry. 9th Edition. W.H. Freeman and Company, 2019.
- ^ Sprenger G.A. Genetics of pentose-phosphate pathway enzymes of Escherichia coli K-12. Arch Microbiol 1995;164(5):324-30. doi:10.1007/BF02529978
- ^ a b c Au S.W.N., Gover S., Lam V.M.S., Adams M.J. Human glucose-6-phosphate dehydrogenase: the crystal structure reveals a structural NADP+ molecule and provides insights into enzyme deficiency. Structure 2000;8(3):293-303. doi:10.1016/S0969-2126(00)00104-0
- ^ a b c Harvey R.A., Ferrier D.R. Lippincott’s illustrated reviews: biochemistry. 5th Edition. Lippincott Williams & Wilkins, 2011.
- ^ Levy H.R. Glucose-6-phosphate dehydrogenase from Leuconostoc mesenteroides. Biochem Soc Trans. 1989 Apr;17(2):313-5. doi:10.1042/bst0170313
- ^ Cosgrove M.S., Naylor C., Paludan S., Adams M.J., Richard Levy H. On the mechanism of the reaction catalyzed by glucose 6-phosphate dehydrogenase. Biochemistry 1998;37(9);2759-2767. doi:10.1021/bi972069y
- ^ Stanton R.C. Glucose 6-phosphate dehydrogenase, NADPH, and cell survival. IUBMB Life 2012;64(5):362-9. doi:10.1002/iub.1017
- ^ a b c Patra K.C., Hay N. The pentose phosphate pathway and cancer. Trends Biochem Sci 2014;39(8):347-354. doi:10.1016/j.tibs.2014.06.005
- ^ García-Domínguez E., Carretero A., Viña-Almunia A., Domenech-Fernandez J., Olaso-Gonzalez G., Viña J., Gomez-Cabrera M.C. Glucose 6-P dehydrogenase – An antioxidant enzyme with regulatory functions in skeletal muscle during exercise. Cells 2022;11(19):3041. doi:10.3390/cells11193041
- ^ Phégnon L., Pérochon J., Uttenweiler-Joseph S., Cahoreau E., Millard P., Létisse F. 6-Phosphogluconolactonase is critical for the efficient functioning of the pentose phosphate pathway. FEBS J 2024;291(20):4459-4472. doi:10.1111/febs.17221
- ^ a b Ruda G.F., Campbell G., Alibu V.P., Barrett M.P., Brenk R., Gilbert I.H. Virtual fragment screening for novel inhibitors of 6-phosphogluconate dehydrogenase. Bioorg Med Chem 2010;18(14):5056-62. doi:10.1016/j.bmc.2010.05.077
- ^ a b Hanau S., Montin K., Cervellati C., Magnani M., Dallocchio F. 6-Phosphogluconate dehydrogenase mechanism: evidence for allosteric modulation by substrate. J Biol Chem 2010;285(28):21366-21371. doi:10.1074/jbc.M110.105601
- ^ Allard S.T., Giraud M.F., Naismith J.H. Epimerases: structure, function and mechanism. Cell Mol Life Sci 2001;58(11):1650-65. doi:10.1007/PL00000803
- ^ Samuel J., Tanner M.E. Mechanistic aspects of enzymatic carbohydrate epimerization. Nat Prod Rep 2002;19(3):261-77. doi:10.1039/b100492l
- ^ Bartkevihi L., Caruso Í.P., Martins B., Pires, J.R.M., Oliveira D.M.P., Anobom C.D., Almeida, F.C.L. Insights into the substrate uptake mechanism of Mycobacterium tuberculosis ribose 5-phosphate isomerase and perspectives on drug development. Biophysica 2023;3:139-157. doi:10.3390/biophysica3010010
- ^ Zhang R., Andersson C.E., Savchenko A., Skarina T., Evdokimova E., Beasley S., Arrowsmith C.H., Edwards A.M., Joachimiak A., Mowbray S.L. Structure of Escherichia coli ribose-5-phosphate isomerase: a ubiquitous enzyme of the pentose phosphate pathway and the Calvin cycle. Structure 2003;11(1):31-42. doi:10.1016/S0969-2126(02)00933-4
- ^ Kabashima T., Kawaguchi T., Wadzinski B.E., Uyeda K. Xylulose 5-phosphate mediates glucose-induced lipogenesis by xylulose 5-phosphate-activated protein phosphatase in rat liver. Proc Natl Acad Sci USA 2003;100:5107-5112. doi:10.1073/pnas.0730817100
- ^ Jelakovic S., Kopriva S., Süss K-H, Schulz G.E. Structure and catalytic mechanism of the cytosolic D-ribulose-5-phosphate 3-epimerase from rice. J Mol Biol 2003;326:127-135. doi:10.1016/S0022-2836(02)01374-8
- ^ a b c Kochetov G.A., Solovjeva O.N. Structure and functioning mechanism of transketolase. Biochim Biophys Acta 2014;1844(9):1608-1618. doi:10.1016/j.bbapap.2014.06.003
- ^ Solovjeva O.N. Regulation of enzymes with identical subunits on the example of transketolase. Open J Anal Bioanal Chem 2022;6(1):004-012. doi:10.17352/ojabc.000024
- ^ Sharkey T.D. Pentose phosphate pathway reactions in photosynthesizing cells. Cells 2021;10(6):1547. doi:10.3390/cells10061547
- ^ a b Lehwess-Litzmann A., Neumann P., Parthier C., Lüdtke S., Golbik R., Ficner R., Tittmann K. Twisted Schiff base intermediates and substrate locale revise transaldolase mechanism. Nat Chem Biol 2011;7(10):678-84. doi:10.1038/nchembio.633
- ^ Van Schaftingen E., Hers H-G. Inhibition of fructose-1,6-bisphosphatase by fructose-2,6-bisphosphate. Proc Natl Acad Sci USA 1981;78(5):2861-2863. doi:10.1073/pnas.78.5.2861
- ^ Van Schaftingen E., Jett M-F., Hue L., Hers H-G. Control of liver 6-phosphofructokinase by fructose 2,6-bisphosphate and other effectors. Proc Natl Acad Sci USA 1981;78(6):3483-3486. doi:10.1073/pnas.78.6.3483