I flavonoidi sono i polifenoli più abbondanti nella dieta dell’uomo, rappresentandone circa i 2/3 di tutti i quelli assunti. Come gli altri fitochimici sono il prodotto del metabolismo secondario delle piante e, al momento, non è possibile stabilire precisamente il loro numero, anche se ne sono stati identificati oltre 4000.
Nella frutta e nella verdura si trovano generalmente in forma di glicosidi e in alcuni casi acilglicosidi, mentre meno frequentemente, e in concentrazioni minori, in forme acilate, metilate e solfate.
Sono molecole idrosolubili e si accumula all’interno dei vacuoli cellulari.
Indice
Struttura chimica dei flavonoidi
La loro struttura di base è costituita da uno scheletro di difenilpropano, ossia due anelli benzenici collegati da una catena di tre atomi di carbonio che forma un anello piranico (anello eterociclico contenente ossigeno) chiuso con l’anello benzenico A, che è detto anello C. La loro struttura è pertanto definita anche come C6-C3-C6.
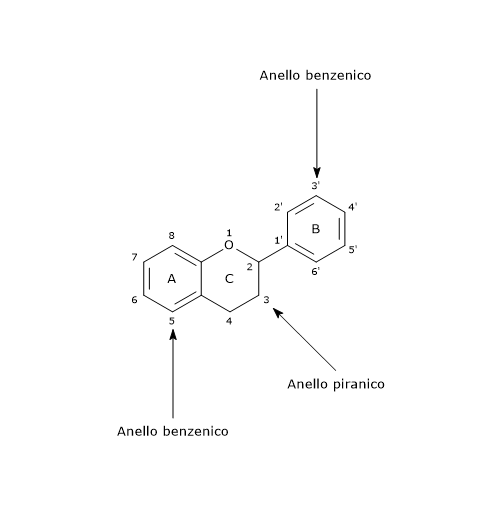
Nella maggior parte dei casi l’anello B si lega all’anello C in posizione 2, ma può legarsi anche in posizione 3 o 4; questo, insieme con le caratteristiche strutturali dell’anello B e gli schemi di glicosilazione e idrossilazione dei tre anelli, fa si che i flavonoidi siano il gruppo di fitochimici, quindi non solo di polifenoli, più ampio e diversificato presente in natura.
Le attività biologiche di questi composti, ad esempio sono dei potenti antiossidanti, dipendono sia dalle caratteristiche strutturali che dallo schema di glicosilazione.
Classificazione dei flavonoidi
Possono essere suddivisi in diverse sottoclassi sulla base del carbonio dell’anello C su cui va a legarsi l’anello B, e del grado di insaturazione e ossidazione dell’anello C.
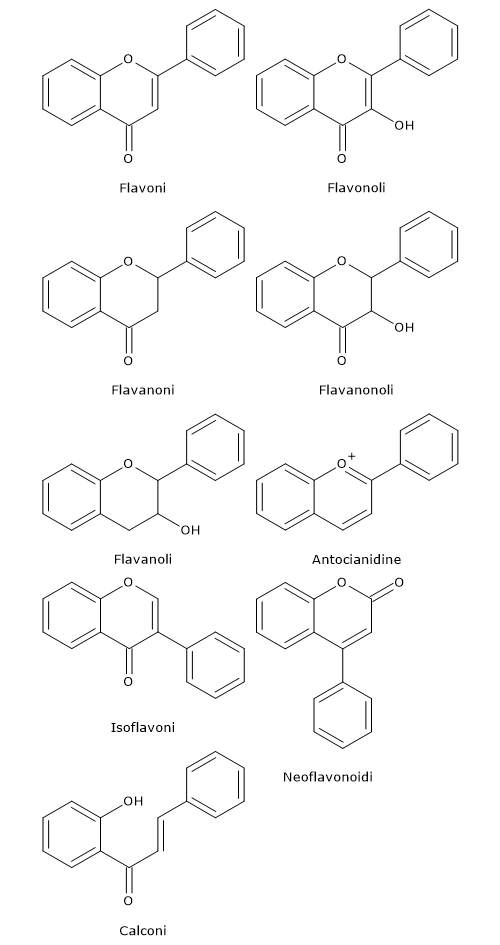
I flavonoidi in cui l’anello B si lega in posizione 3 dell’anello C sono detti isoflavoni; quelli in cui l’anello B si lega in posizione 4 neoflavonoidi, mentre quelli in cui l’anello B si lega in posizione 2 a loro volta essere suddividi in sei sottogruppi sulla base delle caratteristiche strutturali dell’anello C: flavoni, flavonoli, flavanoni, flavanonoli, flavanoli o catechine e antociani.
Infine, i flavonoidi con l’anello C aperto sono detti calconi.
Flavoni
Hanno un doppio legame tra la posizione 2 e 3 e un chetone in posizione 4 dell’anello C. La maggior parte dei flavoni della verdura e frutta presenta un gruppo idrossilico in posizione 5 dell’anello A, mentre l’idrossilazione in altre posizioni, per la maggior parte in posizione 7 dell’anello A o 3’ e 4’ dell’anello B, possono variare a seconda della classificazione tassonomica della particolare verdura o frutta.
La glicosilazione si verifica per la maggior parte sulle posizione 5 e 7, la metilazione e l’acilazione sui gruppi idrossilici dell’anello B.
Alcuni flavoni, come la nobiletina e la tangerina, sono polimetossilati.
Flavonoli
I flavonoli rispetto ai flavoni presentano un gruppo ossidrilico in posizione 3 dell’anello C, gruppo ossidrilico che può essere anche glicosilato. Di nuovo, al pari dei flavoni, anche i flavonoli sono molto vari per quello che riguarda l’idrossilazione e la metilazione, e, considerando i vari schemi di glicosilazione, i sono forse il sottogruppo più comune e ampio di flavonoidi nella frutta e verdura. Ad esempio, la quercetina è presente in moltissimi alimenti vegetali.
Flavanoni
I flavanoni, anche detti diidroflavoni, hanno l’anello C saturo; quindi, a differenza dei flavoni, mancano del doppio legame tra le posizione 2 e 3 e questa è l’unica differenza strutturale tra i due sottogruppi di flavonoidi. I flavanoni possono essere multi-idrossilati, e diversi gruppi idrossilici possono essere metilati e/o glicosilati. Alcuni hanno modelli unici di sostituzione, ad esempio, flavanoni prenilati, furanoflavanoni, piranoflavanoni o flavanoni benzilati, dando un gran numero di derivati sostituiti.
Negli ultimi 15 anni il numero dei flavanoni scoperti è notevolmente aumentato.
Flavanonoli
I flavanonoli, anche detti diidroflavonoli, sono i 3-idrossi derivati dei flavanoni; sono un sottogruppo altamente diversificato e multisostituito.
Isoflavoni
Come anticipato, gli isoflavoni sono flavonoidi in cui l’anello B si lega in posizione 3 dell’anello C. Hanno analogie strutturali con gli estrogeni, come l’estradiolo, e per questo sono anche detti fitoestrogeni.
Catechine
Le catechine o flavanoli sono dette anche flavan-3-oli poiché il gruppo ossidrilico è quasi sempre legato in posizione 3 dell’anello C; altro nome comune è catechine.
A differenza di molti flavonoidi non presentano un doppio legame tra le posizione 2 e 3; altro carattere distintivo, ad esempio rispetto ai flavanonoli, con cui condividono un ossidrile in posizione 3, è l’assenza di un carbonile, un gruppo chetonico, in posizione 4. Questa particolare struttura chimica permette ai flavanoli di avere due centri di chiralità nella molecola, sulle posizioni 2 e 3, quindi quattro possibili diastereoisomeri. La catechina è l’isomero con configurazione trans e la epicatechina è quello con configurazione cis. Ciascuna di queste due configurazioni ha due stereoisomeri, cioè, (+)-catechina e (-)-catechina, (+)-epicatechina e (-)-epicatechina.
La (+)-catechina e (-)-epicatechina sono i due isomeri spesso presenti nelle piante commestibili.
Un’altra importante caratteristica dei flavanoli, in particolare della catechina e della epicatechina, è quella di formare polimeri, detti proantocianidine o tannini condensati. Il nome “proantocianidine” deriva dal fatto che un clivaggio acido catalizzato produce antocianidine.
Le proantocianidine in genere contengono da 2 a 60 monomeri di flavanolo (catechina o epicatechina).
Sia i flavanoli monometrici che quelli oligomerici (da 2 a 7 monomeri) sono potenti antiossidanti.
Antocianidine
Chimicamente, le antocianidine sono cationi di flavilio e per la maggior parte si trovano come sali di cloruro.
Le antocianine o antociani sono i glicosidi delle antocianidine; lo zucchero si lega per la maggior parte dei casi in posizione 3 dell’anello C, zucchero che spesso si coniuga con acidi fenolici come l’acido ferulico.
Sono l’unico gruppo di flavonoidi che conferisce colore ai vegetali (tutti gli altri flavonoidi sono privi di colore). Il colore degli antociani dipende dal pH e dall’acilazione o metilazione dei gruppi idrossilici sugli anelli A e B.
Calconi
I calconi e gli diidrocalconi vengono considerati flavonoidi con struttura aperta; sono classificati tra i flavonoidi in quanto hanno vie di sintesi simili.
Bibliografia
- de la Rosa L.A., Alvarez-Parrilla E., Gonzàlez-Aguilar G.A. Fruit and vegetable phytochemicals: chemistry, nutritional value, and stability. 1th Edition. Wiley J. & Sons, Inc., Publication, 2010
- Han X., Shen T. and Lou H. Dietary polyphenols and their biological significance. Int J Mol Sci 2007;9:950-988. doi:10.3390/i8090950
- Manach C., Scalbert A., Morand C., Rémésy C., and Jime´nez L. Polyphenols: food sources and bioavailability. Am J Clin Nutr 2004;79(5):727-747. doi:10.1093/ajcn/79.5.727
- Panche A.N., Diwan A.D., and Chandra S.R. Flavonoids: an overview. J Nutr Sci. 2016;5:e47. doi:10.1017/jns.2016.41
- Tsao R. Chemistry and biochemistry of dietary polyphenols. Nutrients 2010;2:1231-1246. doi:10.3390/nu2121231