La biosintesi dei flavonoidi, probabilmente la via metabolica meglio caratterizzata tra quelle del metabolismo secondario delle piante, fa parte della via biosintetica dei fenilpropanoidi, che porta alla formazione, oltre che dei flavonoidi, anche di un’ampia gamma di composti fenolici quali gli acidi idrossicinnamici, gli stilbeni, i lignani e le lignine.
La biosintesi dei flavonoidi è legata al metabolismo primario da intermedi di derivazione sia mitocondriale che plastidica. Queste molecole dovranno essere trasportate nel citoplasma per essere utilizzate, in quanto sembra che la maggior parte degli enzimi coinvolti sino ad ora caratterizzati lavorino uniti in complessi localizzati nel citosol della cellula.
I prodotti finali raggiungono i vari distretti intra- od extracellulari, con i flavonoidi coinvolti nella pigmentazione in genere trasportati all’interno dei vacuoli.
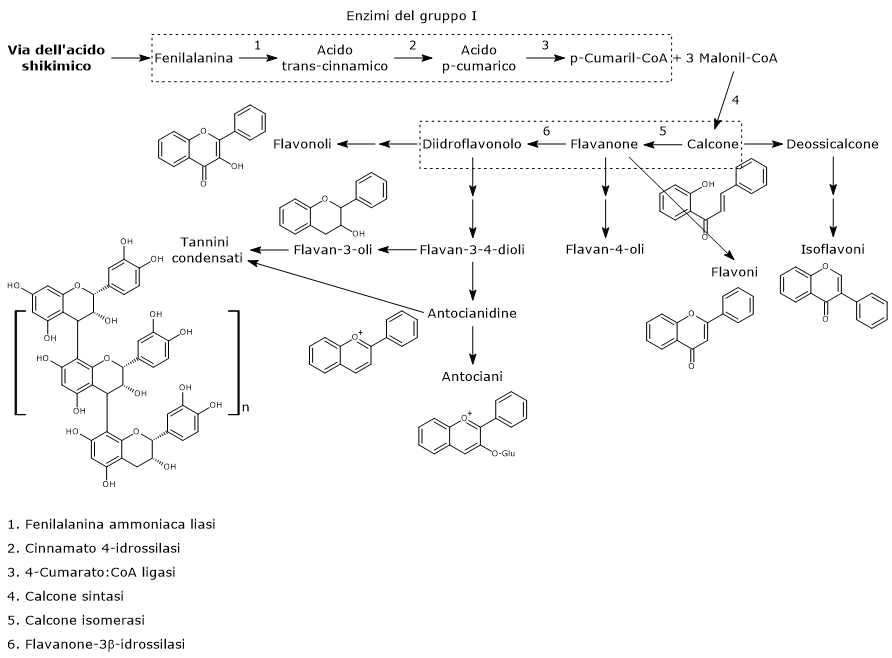
La biosintesi di questo ampio gruppo di polifenoli richiede come substrati iniziali una molecola di p-cumaril-CoA e tre di malonil-CoA.
Indice
- Biosintesi del p-cumaril-CoA
- Biosintesi del malonil-CoA
- Passaggi iniziali della biosintesi dei flavonoidi
- Bibliografia
Biosintesi del p-cumaril-CoA
Il p-cumaril-CoA rappresenta il più importante punto di ramificazione della via dei fenilpropanoidi, essendo il precursore di un’ampia varietà di prodotti fenolici, di natura sia flavonoide che non flavonoide.
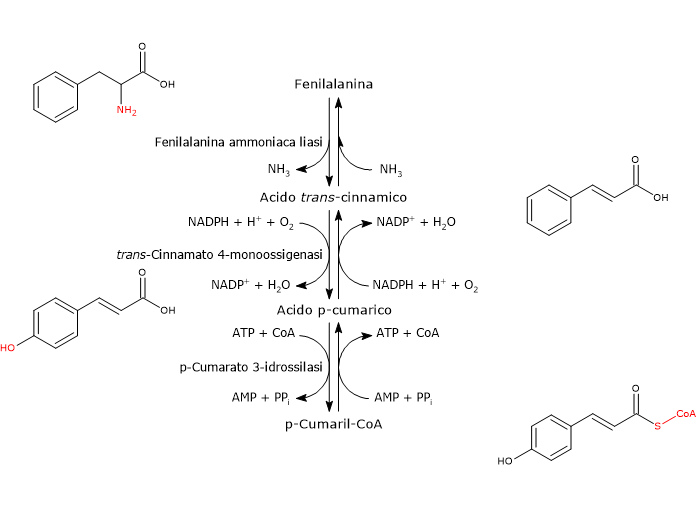
E’ prodotto a partire dalla fenilalanina attraverso un nucleo di tre reazioni catalizzate da enzimi ad azione citosolica detti enzimi del gruppo I od ad azione precoce, in ordine di azione:
- fenilalanina ammoniaca liasi (EC 4.3.1.24);
- trans-cinnamato 4-monoossigenasi (EC:1.14.14.91);
- 4-cumarato:CoA ligasi (EC 6.2.1.12).
Sembra che questi enzimi si associno a formare un complesso multienzimatico ancorato al reticolo endoplasmatico, ancoraggio probabilmente assicurato dalla cinnamato 4-idrossilasi che inserisce il proprio dominio N-terminale nella membrana del reticolo stesso. Queste strutture, definite “metaboloni”, fanno si che il prodotto di una reazione sia incanalato direttamente verso il sito attivo dell’enzima che catalizza la reazione successiva.
Con l’esclusione della cinnamato 4-idrossilasi, in tutte le specie analizzate gli enzimi che intervengono a valle della fenilalanina ammoniaca liasi sono codificati da piccole famiglie di geni.
Le diverse forme isoenzimatiche mostrano pattern di espressione temporali, tissutali e indotti da elicitori, distinti; sembra infatti che ogni membro di ciascuna famiglia possa essere utilizzato soprattutto per la sintesi di uno specifico composto, agendo in questo modo come punto di controllo del flusso del carbonio verso le vie di biosintesi dei flavonoidi, lignani e lignine.
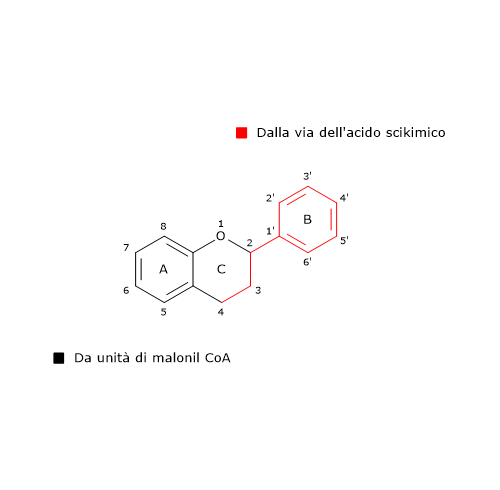
Nota: la fenilalanina, che da il nome alla via dei fenilpropanoidi, è un prodotto della via dell’acido shikimico, via che converte semplici precursori derivanti dal metabolismo dei carboidrati, fosfoenolpiruvato e eritrosio-4-fosfato, intermedi rispettivamente dalla glicolisi e della via del pentoso fosfato, negli aminoacidi aromatici fenilalanina, tirosina e triptofano. Poiché gli animali non posseggono questa via metabolica, presente invece nelle piante e nei microorganismi, non sono in grado di sintetizzare i tre aminoacidi suddetti, che dunque risultano essenziali.
Fenilalanina ammonica liasi
E’ uno degli enzimi meglio studiati e caratterizzati del metabolismo secondario delle piante. Non richiede cofattori e catalizza la reazione che lega il metabolismo primario e quello secondario: la deaminazione della fenilalanina in acido trans-cinnamico, con liberazione dell’azoto in forma di ammoniaca e inserzione di un doppio legame trans tra il C7 e il C8 della catena laterale.
Fenilalanina ⇄ Acido trans-Cinnamico + NH3
Quindi dirige il flusso di carbonio dalla via dello shikimato a quella delle varie branche del metabolismo fenilpropanoico. L’ammoniaca rilasciata viene probabilmente fissata nella reazione catalizzata dalla glutammina sintetasi.
L’enzima presente nelle monocotiledoni è anche in grado di agire come tirosina ammoniaca liasi (EC 4.3.1.25), convertendo direttamente la tirosina in acido p-cumarico (saltando quindi la idrossilazione in posizione 4), anche se con efficienza minore rispetto all’attività sulla fenilalanina.
In tutte le specie sono state trovate numerose copie dei geni per la fenilalanina ammoniaca liasi, copie che probabilmente rispondono in maniera differente a stimoli interni ed esterni. La trascrizione del gene e dunque l’attività dell’enzima è infatti sottoposta a regolazione da parte di fattori interni legati allo sviluppo e fattori esterni. Di seguito alcuni esempi che richiedono un aumento dell’attività dell’enzima.
- La fioritura.
- La produzione di lignina per il rafforzamento della parete cellulare secondaria delle cellule dello xilema.
- La produzione di pigmenti per attrarre gli impollinatori.
- L’attacco di patogeni che richieda la produzione di fitoalessine di natura fenilpropanoica, o l’esposizione a raggi UV.
trans-Cinnamato 4-monoossigenasi
Enzima della famiglia del citocromo P450 (EC 1.14.-.-), è una monossigenasi a localizzazione microsomiale, contenente un gruppo eme come cofattore, e dipendente dal NADPH e dall’ossigeno molecolare. Catalizza l’introduzione del gruppo ossidrilico in posizione 4 dell’acido trans-cinnamico (gruppo ossidrilico che si osserva nella maggior parte dei flavonoidi conosciuti) e formazione di acido p-cumarico.
Acido trans-Cinnamico + NADPH + H+ + O2 ⇄ Acido p-Cumarico + NADP+ + H2O
Questa reazione fa parte anche della via di sintesi degli acidi idrossicinnamici.
Aumenti nei livelli di trascrizione del gene e di attività dell’enzima sono stati osservati in correlazione con la sintesi di fitoalessine in risposta a infezioni fungine, la lignificazione o lesioni alla pianta.
4-Cumarato:CoA ligasi
In presenza di Mg2+ che agisce da cofattore, permette l’attivazione ATP-dipendente del gruppo carbossilico dell’acido p-cumarico e degli altri acidi idrossicinnamici, di per se piuttosto inerti, attraverso la formazione dei corrispondenti CoA-tioestere.
Acido p-Cumarico + ATP + CoA ⇄ p-Cumaril-CoA + AMP + PPi
In genere l’acido p-cumarico e l’acido caffeico sono i substrati preferiti, seguiti dall’acido ferulico e dall’acido 5-idrossiferulico, mentre si osserva una bassa attività nei confronti dell’acido trans-cinnamico e nessuna nei confronti dell’acido sinapico. I CoA-tioesteri prodotti sono in grado di entrare in differenti vie metaboliche come:
- la riduzione ad aldeidi e alcol (monolignoli);
- l’addizione di unità di acetato fornite dal malonil-CoA, nel caso della biosintesi dei flavonoidi e degli stilbeni;
- il trasferimento a molecole accettrici.
Va infine sottolineato che l’attivazione del gruppo carbossilico può essere ottenuta anche attraverso il trasferimento al glucosio dipendente non dall’ATP ma dall’UDP-glucosio.
Biosintesi del malonil-CoA
Il malonil-CoA non deriva dalla via dei fenilpropanoidi, ma si forma nella reazione catalizzata dall’acetil-CoA carbossilasi (EC 6.4.1.2, la forma citosolica). L’enzima, che ha come cofattori la biotina e il Mg2+, catalizza la carbossilazione ATP-dipendente dell’acetil-CoA, utilizzando lo ione bicarbonato come donatore di anidride carbonica (CO2).
Acetil-CoA + HCO3– + ATP → Malonil-CoA + ADP + Pi
Si trova sia nei plastidi, dove interviene nella sintesi degli acidi grassi, che nel citoplasma, ed è quest’ultimo che catalizza la formazione del malonil-CoA che sarà utilizzato nella biosintesi dei flavonoidi e di altri composti. Aumenti dei livelli di trascrizione del gene e dell’attività dell’enzima sono indotti in risposta a stimoli che aumentano la biosintesi di questi polifenoli, come l’esposizione a funghi patogeni o raggi UV.
A sua volta l’acetil-CoA può essere prodotto nei mitocondri, plastidi, perossisomi e nel citosol attraverso differenti vie metaboliche. Quello che è utilizzato nella biosintesi del malonil-CoA e quindi dei flavonoidi è di derivazione citosolica, prodotto nella reazione catalizzata dalla ATP-citrato liasi (EC 2.3.3.8) che converte citrato, ATP e CoA in acetil-CoA, ossalacetato, ADP e fosfato inorganico.
Passaggi iniziali della biosintesi dei flavonoidi
Il primo passo nella biosintesi dei flavonoidi è catalizzato dalla calcone sintasi (EC 2.3.1.74), un enzima ancorato al reticolo endoplasmatico e privo di cofattori noti.
In presenza di una molecola di p-cumaril-CoA e tre di malonil-CoA, catalizza una serie di decarbossilazioni e condensazioni sequenziali, nel corso delle quali si forma un intermedio polichetide che subisce ciclizzazioni e aromatizzazioni che portano alla formazione dell’anello A, e la risultante struttura dei calconi. Il prodotto delle reazioni suddette è la naringenina calcone (2’,4,4′,6′-tetraidrossicalcone), un 6’-idrossicalcone e il primo flavonoide prodotto.
p-Cumaril-CoA + 3 Malonil-CoA → Naringenina Calcone + 4 CoA + 3 CO2
La reazione, citosolica, è irreversibile grazie al rilascio di tre molecole di CO2 e 4 di CoA.
L’anello B e il ponte centrale a 3 atomi di carbonio della molecole derivano dal p-cumaril-CoA (e quindi dalla fenilalanina), mentre l’anello A dalle tre unità di malonil-CoA.
Altro possibile prodotto della reazione è il 6’-deossicalcone, la cui sintesi sembra coinvolgere un passaggio addizionale di riduzione catalizzata da una polichetide reduttasi (EC. 1.1.1.-).
Le calcone sintasi di alcune specie, ad esempio l’orzo (Hordeum vulgare), possono accettare come substrati anche il caffeoil-CoA, il feruloil-CoA e il cinnamoil-CoA.
E’ l’enzima più abbondante della via dei fenilpropanoidi, probabilmente perché ha una bassa attività catalitica, ed è infatti considerato l’enzima limitante della via di biosintesi dei flavonoidi.
Come per la fenilalanina ammoniaca liasi, anche la sua sintesi è soggetta a controlli multipli dell’espressione genica ad opera di fattori interni ed esterni. In alcune piante, sono state trovate una o due isoforme, mentre in altre fino a 9.
Appartiene al gruppo delle polichetide sintasi, presenti nei batteri, funghi e piante. Sono enzimi in grado di formare catene polichetidiche attraverso la condensazione sequenziale di unità di acetato provenienti da malonil-CoA. Questa classe di enzimi comprende anche la stilbene sintasi (EC 2.3.1.146), che catalizza la formazione di resveratrolo, un polifenolo non flavonoide difensivo delle piante che ha suscitato molto interesse per la salute umana.
Di solito le piante non accumulano calconi, e infatti dopo la sua formazione la naringenina calcone, nella reazione catalizzata dalla calcone isomerasi (EC 5.5.1.6) viene convertita in (2S)-naringenina, un flavanone.
L’enzima, il primo della via di biosintesi dei flavonoidi a essere scoperto, catalizza una isomerizzazione stereospecifica, chiudendo l’anello C. Sono state ritrovate due tipi di calcone isomerasi, indicate come tipo I e II. Il tipo I può utilizzare come substrati solo i 6’-idrossicalconi, come la naringenina calcone, mentre il tipo II, prevalente nelle leguminose, può catalizzare l’isomerizzazione sia dei 6’-idrossi- che dei 6’-deossicalconi.
Da notare che con i 6’-idrossicalconi l’isomerizzazione può avvenire anche non enzimaticamente a formare una miscela racemica, sia in vitro che in vivo; addirittura sembra con un grado tale da permettere una moderata sintesi di antociani. Al contrario in condizioni fisiologiche i 6’-deossicalconi sono stabili, per cui è richiesta la catalisi ad opera della isomerasi di tipo II per convertirli in flavanoni.
L’enzima assicura un aumento della velocità di reazione di 107 volte rispetto alla reazione spontanea, ma con una cinetica decisamente più lenta con i 6’-deossicalconi rispetto ai 6’-idrossicalconi. Infine permette l’ottenimento dei (2S)-flavanoni, che sono quelli biosinteticamente necessari.
Al pari di altri enzimi della biosintesi dei flavonoidi, anche la sua sintesi è soggetta a uno stretto controllo. E come la fenilalanina ammoniaca liasi e la calcone sintasi, è indotta dagli elicitori.
Nella reazione catalizzata dalla flavanone-3β-idrossilasi (EC 1.14.11.9) i (2S)-flavanoni vanno incontro a una isomerizzazione stereospecifica che li converte nei rispettivi (2R,3R)-diidroflavonoli. In particolare la naringenina è convertita in diidrocampferolo.
L’enzima, citosolico, è una non-eme diossigenasi dipendente dal Fe2+ e dal 2-ossiglutarato, e dunque appartenente alla famiglia delle diossigenasi 2-ossiglutarato-dipendenti (il che le distingue delle altre idrossilasi della via di biosintesi dei flavonoidi che sono enzimi citocromo P450).
La naringenina calcone, la (2S)-naringenina e il suo derivato diidrocampferolo (diidroflavonolo) sono intermedi centrali nella biosintesi dei flavonoidi, essendo punti di ramificazione da cui si diparte la sintesi di distinte sottoclassi di flavonoidi. Ad esempio, direttamente o indirettamente:
- dai calconi derivano gli isoflavoni;
- dai flavanoni i flavoni e i flavan-4-oli;
- dai diidroflavanoli i flavan-3,4-dioli, le antocianidine, le antocianine, le catechine, le proantocianidine o tannini condensati, e i flavonoli.
Non tutte queste vie di sintesi sono presenti in tutte le piante, o sono attive all’interno di ogni tessuto di una data pianta. Al pari degli enzimi visti in precedenza, anche l’attività di quelli coinvolti in queste vie metaboliche “collaterali” è soggetta a uno stretto controllo, che risulta in un profilo di metaboliti di natura flavonoide tessuto specifico. L’esempio è il chicco d’uva, dove la buccia, la polpa e i semi hanno un profilo ben distinto riguardo al contenuto in antociani, catechine, tannini condensati e flavonoli, la cui sintesi e accumulo è strettamente e temporalmente coordinata nel corso dello sviluppo.
Bibliografia
- Andersen Ø.M., Markham K.R. Flavonoids: chemistry, biochemistry, and applications. CRC Press Taylor & Francis Group, 2006
- de la Rosa L.A., Alvarez-Parrilla E., Gonzàlez-Aguilar G.A. Fruit and vegetable phytochemicals: chemistry, nutritional value, and stability. 1th Edition. Wiley J. & Sons, Inc., Publication, 2010
- Heldt H-W. Plant biochemistry – 3th Edition. Elsevier Academic Press, 2005
- Vogt T. Phenylpropanoid biosynthesis. Mol Plant 2010;3(1):2-20. doi:10.1093/mp/ssp106
- Wink M. Biochemistry of plant secondary metabolism – 2nd Edition. Annual plant reviews (v. 40), Wiley J. & Sons, Inc., Publication, 2010