Sebbene siano stati proposti diversi tipi di classificazione delle proteine, al momento non ne esistono di universalmente validi.
Di seguito alcuni esempi in base alla composizione chimica, struttura, funzione, e solubilità in solventi differenti.
Indice
- Classificazione delle proteine in base alla composizione chimica
- Classificazione delle proteine in base alla forma
- Classificazione delle proteine in base alla funzione biologica
- Classificazione in base alla solubilità
- Bibliografia
Classificazione delle proteine in base della composizione chimica
In base alla composizione chimica le proteine possono essere suddivise in due classi: semplici e complesse.
Proteine semplici
Anche dette omoproteine, sono formate solamente da aminoacidi. Esempi sono l’albumina del plasma, il collagene e le cheratine.
Proteine complesse o coniugate
A volte dette eteroproteine, nella loro struttura hanno anche una parte non proteica.
Tre esempi sono le glicoproteine, le cromoproteine, le fosfoproteine.
- Glicoproteine
Legano una o più sequenze glucidiche allo scheletro polipeptidico. In genere le ramificazioni sono composte da non più di 15-20 unità di carboidrati, dove si possono ritrovare arabinosio, fucosio o 6-deossigalattosio, galattosio, glucosio, mannosio, N-acetilglucosamina o GlcNAc o NAG, e acido N-acetilneuraminico o Neu5Ac o NANA.
Tra le glicoproteine si ritrovano:
la glicoforina, la più conosciuta tra le glicoproteine di membrana dei globuli rossi;
la fibronectina, che legando da una parte il collagene o altre proteine fibrose e dall’altra la membrana cellulare, ancora le cellule alla matrice extracellulare;
tutte le proteine plasmatiche del sangue, tranne l’albumina; le immunoglobuline o anticorpi.
- Cromoproteine
Sono proteine che legano gruppi prostetici colorati.
Esempi sono:
l’emoglobina e la mioglobina, che legano il gruppo eme e il ferro;
le clorofille, che legano un anello porfirinico con al centro un atomo di magnesio;
le rodopsine, che legano il retinale.
- Fosfoproteine
Sono proteine che legano molecole di acido ortofosforico a residui di serina e treonina.
In genere hanno funzione strutturale, come la dentina dei denti, o di riserva, quali le caseine del latte, rispettivamente alfa, beta, gamma e delta, e la fosvitina del tuorlo uovo.
Classificazione delle proteine in base alla forma
In base alla forma le proteine possono essere suddivise in due classi, fibrose e globulari.
Proteine fibrose
Hanno principalmente ruoli meccanici e strutturali, fornendo sostegno alle singole cellule come all’intero organismo.
Si tratta di proteine insolubili in acqua, conseguenza del fatto che contengono molti aminoacidi idrofobici sia al loro interno che in superficie; e proprio la presenza in superficie di questi aminoacidi idrofobici facilita il loro impacchettamento in strutture sopramolecolari molto complesse. A questo riguardo va sottolineato il fatto che la catena polipeptidica è disposta a formare lunghi filamenti o fogli, dove nella maggior parte dei casi si ritrova un solo tipo di struttura secondaria che si ripete.
Nei vertebrati forniscono protezione esterna, supporto e forma; infatti grazie alle loro proprietà strutturali assicurano flessibilità e/o forza alle strutture che le contengono.
Alcune proteine fibrose, come le cheratine, a livello intestinale sono solo parzialmente idrolizzate.
Di seguito alcuni esempi.
- Fibroina
E’ prodotta da ragni e insetti. Un classico esempio è quella prodotta dal baco della seta, Bombyx mori. - Collagene
Con il termine collagene si indica in realtà una famiglia di proteine fibrose composta da almeno 29 diversi tipi di proteine, che costituiscono la componente principale del tessuto connettivo, e più in generale l’intelaiatura extracellulare degli organismi pluricellulari. Nei vertebrati rappresentano circa il 25-30% di tutte le proteine.
Si trovano in tessuti e organi differenti, come i tendini e la matrice organica delle ossa, dove sono presenti in percentuali molto elevate, ma anche nelle cartilagine e nella cornea dell’occhio. Nei diversi tessuti formano strutture differenti, ognuna in grado di soddisfare la particolare necessità; ad esempio nella cornea le molecole sono disposte in modo quasi cristallino, tanto che risultano praticamente trasparenti, mentre nella pelle formano fibre non molto intrecciate e rivolte in tutte le direzioni che assicurano la resistenza alla trazione della pelle stessa. - alfa-Cheratine
Costituiscono quasi per intero il peso secco di unghie, artigli, becco, zoccoli, corna, capelli, lana e di gran parte dello strato esterno della pelle.
La differente rigidità e flessibilità delle strutture sopracitate è conseguenza del numero di legami disolfuro che concorrono, assieme altri tipi di legame, a stabilizzare la struttura proteica. Ed è per questo che le cheratine della lana, che presentano un piccolo numero di ponti disolfuro, sono flessibili, morbide ed estensibili, al contrario delle cheratine presenti negli artigli e nel becco che sono ricche di ponti disolfuro. - Elastina
Questa proteina assicura elasticità alla cute e ai vasi sanguigni, conseguenza della sua struttura irregolare ad avvolgimento casuale, in inglese “random coiled structure, che la differenzia dalle strutture delle alfa-cheratine e dei diversi tipi di collagene.
Nota: i diversi tipi di collagene hanno uno scarso valore nutrizionale in quanto carenti di diversi aminoacidi essenziali. Infatti non contengono triptofano, e anche gli altri aminoacidi essenziali sono presenti in basse quantità.
La gelatina usata nella preparazione dei cibi è un derivato del collagene.
Proteine globulari
La maggior parte delle proteine appartiene a questa classe.
Hanno una struttura compatta più o meno sferica, più complicata delle proteine fibrose. A questo riguardo va infatti sottolineato il fatto che oltre alle strutture secondarie vi si possono ritrovare anche gli altri tipi di strutture quali motivi, domini, strutture terziarie e quaternarie.
In genere sono solubili in acqua ma si possono ritrovare anche immerse nelle membrane biologiche, dunque in un ambiente idrofobico, e in questo caso si parla di proteine transmembrana o integrali di membrana.
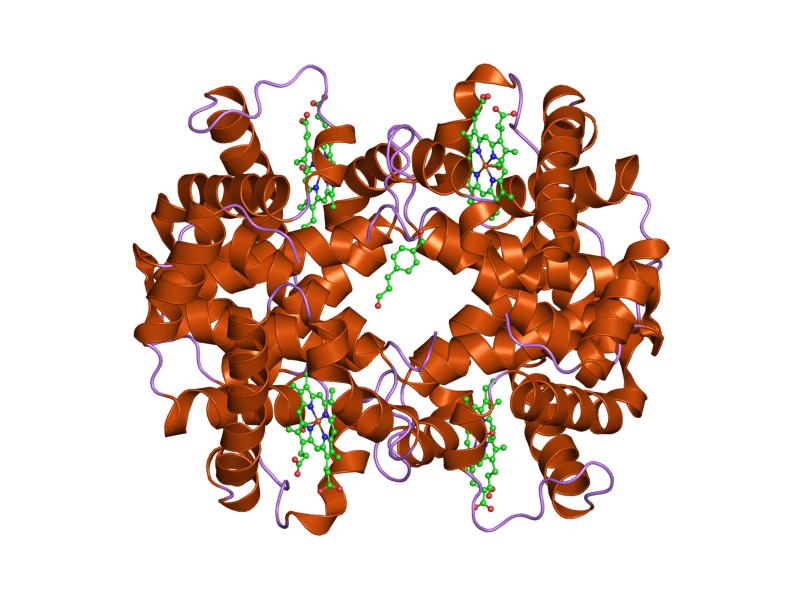
A differenza delle proteine fibrose, che hanno funzioni strutturali e meccaniche, le proteine globulari agiscono come:
- enzimi;
- ormoni proteici;
- trasportatori e recettori di membrana;
- trasportatori di trigliceridi e acidi grassi, che sono due classi di lipidi, e ossigeno nel sangue;
- immunoglobuline o anticorpi;
- proteine di riserva nei cereali e legumi.
Esempi classici sono la mioglobina, l’emoglobina e i citocromo c.
A livello intestinale la maggior parte delle proteine globulari di origine animale è idrolizzate quasi per intero ad aminoacidi.
Classificazione delle proteine in base alla funzione biologica
Il grande spettro di funzioni che le differenti proteine sono in grado di svolgere è la conseguenza sia del ripiegamento della catena polipeptidica, dunque della struttura tridimensionale, che della presenza di molti gruppi funzionali differenti nelle catene laterali degli aminoacidi, quali tioli, alcool, tioeteri, carbossammidi, acidi carbossilici e diversi gruppi basici.
Dal punto di vista funzionale le proteine possono essere suddivise in diversi gruppi.
- Enzimi
Nei sistemi biologici praticamente tutte le reazioni sono catalizzate da specifiche molecole dette enzimi, che sono dotate di un potere catalitico notevole, essendo in grado di aumentare la velocità della specifica reazione cui partecipano di almeno un milione di volte. Pertanto la vita come la conosciamo non potrebbe esistere senza la loro azione “facilitatrice”.
Quasi tutti gli enzimi conosciuti, e nel corpo umano sono migliaia, sono proteine. Fanno eccezione alcuni tipi di RNA dotati di attività catalitica detti ribozimi, dall’inglese ribonucleic acid enzymes. - Proteine di trasporto
Moltissime molecole di piccole dimensioni, organiche e inorganiche, sono trasportate nel sangue e nei liquidi extracellulari, dall’esterno all’interno delle cellule e viceversa, e all’interno delle cellule da un distretto a un altro, da specifiche proteine.
Esempi sono:
l’emoglobina, che trasporta l’ossigeno dal sangue alveolare ai capillari dei tessuti periferici;
la transferrina, che trasporta il ferro nel sangue;
i carrier di membrana;
le proteine deputate al trasporto degli acidi grassi all’interno delle cellule, in sigla FABP, acronimo dell’inglese fatty acid binding proteins;
la componente proteica delle lipoproteine plasmatiche, complessi macromolecolare formati da lipidi e proteine, deputate al trasporto dei trigliceridi, altrimenti insolubili in acqua;
l’albumina, che trasporta nel sangue gli acidi grassi liberi, la bilirubina, gli ormoni tiroidei e alcuni farmaci come l’aspirina e la penicillina.
Molte di queste proteine svolgono anche una funzione protettiva in quanto le molecole da esse trasportate, come ad esempio gli acidi grassi, possono essere, se presenti in forma libera, dannose per organismo.
- Proteine di deposito
Esempi sono:
la ferritina, che immagazzina il ferro all’interno della cellula in una forma non tossica;
le caseine del latte, che rappresentano una riserva di aminoacidi per il latte stesso;
la fosvitina del tuorlo, che contiene elevate quantità di fosforo;
le prolamine e gluteline che sono le proteine di riserva dei cereali.
- Supporto meccanico
Sono essenziali nella stabilizzazione di molte strutture.
Esempi sono le alfa-cheratine, il collagene e l’elastina. Lo stesso citoscheletro, l’impalcatura della cellula, è formato da proteine. - Generano movimento.
A loro si deve tra gli altri:
la contrazione dei muscoli, di cui sono le principali componenti, ad esempio l’actina e la miosina;
la propulsione degli spermatozoi e dei microorganismi dotati di flagelli;
la separazione dei cromosomi durante la mitosi.
- Intervengono nella trasmissione nervosa.
Un esempio è il recettore per l’acetilcolina a livello delle sinapsi. - Controllano lo sviluppo e la differenziazione.
Si tratta di proteine che intervengono nella regolazione dell’espressione genica. Un esempio è il fattore di crescita nervoso (NGF) scoperto da Rita Levi Montalcini, che dirige la formazione delle reti neurali. - Ormoni
Molti ormoni sono di natura proteica.
Sono proteine di regolazione che intervengono nel controllo di diverse funzioni cellulari, dal metabolismo alla riproduzione. Esempi sono l’insulina, il glucagone e l’ormone stimolante la tiroide (TSH). - Protezione nei confronti di agenti nocivi
Gli anticorpi o immunoglobuline sono glicoproteine che legano antigeni espressi sulla superficie di virus, batteri e altri agenti infettivi.
In questo gruppo sono presenti anche l’interferone, il fibrinogeno, e i fattori della coagulazione del sangue. - Deposito di energia
Le proteine, in particolare gli aminoacidi che le costituiscono, rappresentano un deposito di energia secondo per grandezza solo al tessuto adiposo, e, in determinate condizioni metaboliche come il digiuno prolungato, possono divenire essenziali per la sopravvivenza. Tuttavia, una loro riduzione superiore al 30% comporta riduzioni della capacità di contrazione dei muscoli respiratori, della funzione immunitaria e delle funzionalità d’organo non compatibili con la vita. Pertanto sono un carburante estremamente prezioso.
Classificazione in base alla solubilità
Le diverse proteine globulari possono essere classificate in base alla solubilità in solventi differenti, quali acqua, soluzioni saline e alcool. Per una trattazione più approfondita si veda l’articolo sul glutine.
Bibliografia
- Kessel A., Ben-Tal N. Introduction to proteins: structure, function, and motion. CRC Press, 2011. doi:10.1002/cbic.201100254
- Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 3rd Edition. Elsevier health sciences, 2012