La classificazione delle proteine è un approccio utile per organizzare la grande diversità di queste molecole presenti negli organismi viventi. Le proteine differiscono notevolmente per composizione chimica, struttura, proprietà fisico-chimiche e ruoli biologici; tali differenze riflettono la varietà di funzioni che svolgono nelle cellule e nei tessuti.
Nel tempo sono stati proposti diversi metodi di classificazione delle proteine, ciascuno basato su una caratteristica specifica della molecola proteica. Alcune classificazioni si basano sulla composizione chimica, distinguendo tra proteine semplici e coniugate, mentre altre si concentrano sulla forma molecolare, separando le proteine fibrose da quelle globulari. Altri approcci classificano le proteine in base alle loro funzioni biologiche, come l’attività enzimatica, il trasporto, il supporto strutturale o la regolazione. Infine, le proprietà fisico-chimiche, compresa la solubilità in diversi solventi, forniscono un criterio pratico particolarmente utile nella chimica sperimentale delle proteine.
Nessuno di questi sistemi di classificazione è universalmente applicabile, poiché ciascuno evidenzia solo alcuni aspetti della struttura e del comportamento delle proteine. Per questo motivo, spesso ne vengono utilizzati parallelamente diversi. Nelle sezioni seguenti è descritta e discussa la classificazione delle proteine in base alla composizione chimica, alla forma, alla funzione biologica e alla solubilità.
In Sintesi: Punti Chiave
- Classificazione in base alla composizione: si distinguono in semplici (solo amminoacidi) e coniugate (contengono un gruppo prostetico come lipidi o zuccheri).
- Classificazione in base alla forma: le proteine fibrose hanno ruoli strutturali (es. collagene), mentre le globulari svolgono funzioni metaboliche e di trasporto (es. enzimi, emoglobina).
- Classificazione in base alla funzione: coprono una gamma vastissima: catalisi (enzimi), difesa (anticorpi), movimento (miosina), trasporto (albumina), regolazione (ormoni) e riserva energetica (l’ultima risorsa del corpo dopo grassi e carboidrati).
- Classificazione in base alla solubilità: basata sul comportamento in diversi solventi (include la classificazione di Osborne delle proteine vegetali in albumine, globuline, prolamine e gluteline).
Indice
- Classificazione delle proteine in base alla composizione chimica
- Classificazione delle proteine in base alla forma
- Classificazione delle proteine in base alle funzioni biologiche
- Classificazione delle proteine in base alla solubilità
- Bibliografia
Classificazione delle proteine in base alla composizione chimica
In base alla loro composizione chimica, le proteine possono essere classificate a seconda che siano costituite esclusivamente da amminoacidi o che contengano anche componenti non proteici aggiuntivi. Questa distinzione riflette importanti differenze nella struttura, nelle proprietà fisico-chimiche e nella funzione biologica. Secondo questo criterio, le proteine sono suddivise in due classi principali: proteine semplici e proteine coniugate.
Proteine semplici
Le proteine semplici, note anche come omoproteine, sono composte esclusivamente da amminoacidi e non contengono componenti non proteici, per cui una volta idrolizzate producono solo amminoacidi. Nonostante la loro composizione chimica relativamente semplice, queste proteine possono svolgere una vasta gamma di funzioni strutturali, meccaniche e fisiologiche. Esempi di proteine semplici includono l’albumina plasmatica, il collagene e la cheratina.
Proteine coniugate
Le proteine coniugate, note anche come eteroproteine, sono proteine che contengono, oltre alla catena polipeptidica, un componente non proteico noto come gruppo prostetico. Questo componente è strettamente legato alla proteina in modo in modo saldo (spesso covalentemente) ed è essenziale per la sua attività biologica. A seconda della natura del gruppo prostetico, le proteine coniugate possono essere coinvolte in processi di trasporto, organizzazione strutturale, segnalazione o possono avere un’azione catalitica. Importanti classi di proteine coniugate includono glicoproteine, cromoproteine e fosfoproteine.
Glicoproteine
Le glicoproteine sono proteine che legano in modo covalente una o più unità di carboidrati alla struttura polipeptidica. In genere, le catene di carboidrati sono costituite da non più di 15−20 unità monosaccaridiche, che possono includere arabinosio, fucosio (6-desossigalattosio), galattosio, glucosio, mannosio, N-acetilglucosamina (GlcNAc o NAG) e acido N-acetilneuraminico (Neu5Ac o NANA).
Esempi di glicoproteine includono:
- glicoforina, una delle glicoproteine più note della membrana dei globuli rossi;
- fibronectina, che ancora le cellule alla matrice extracellulare attraverso interazioni con il collagene o altre proteine fibrose da un lato e con le membrane cellulari dall’altro;
- tutte le proteine del plasma sanguigno, ad eccezione dell’albumina;
- immunoglobuline, note anche come anticorpi.
Cromoproteine
Le cromoproteine sono proteine che contengono gruppi prostetici colorati responsabili del loro caratteristico assorbimento della radiazione visibile.
Esempi tipici includono:
- emoglobina e mioglobina, che legano rispettivamente quattro e un gruppo eme;
- complessi clorofilla-proteina, dove il pigmento presenta un anello porfirinico contenente un atomo di magnesio al centro;
- rodopsine, che legano il retinale.
Fosfoproteine
Le fosfoproteine sono proteine in cui l’acido fosforico è legato in modo covalente ai residui di serina, treonina e tirosina. Generalmente svolgono funzioni strutturali, come nella dentina dei denti, o funzioni di riserva, come nelle caseine del latte (α-, β-, γ- e δ-caseine) e nella fosvitina del tuorlo d’uovo.
Classificazione delle proteine in base alla forma
La classificazione delle proteine in base alla forma tiene conto dell’organizzazione tridimensionale della catena polipeptidica e del modo in cui le molecole proteiche sono assemblate nello spazio. La forma molecolare di una proteina è strettamente correlata alla sua sequenza amminoacidica, alle strutture secondarie e terziarie e, in ultima analisi, alla sua funzione biologica. Dal punto di vista strutturale, le proteine presentano proprietà fisiche notevolmente diverse, quali solubilità, flessibilità e resistenza meccanica.
In base alla loro forma, le proteine possono essere suddivise in due classi principali: proteine fibrose e proteine globulari. Questi due gruppi differiscono non solo nella loro conformazione tridimensionale, ma anche nel loro comportamento fisico-chimico, nei ruoli biologici e nelle proprietà nutrizionali.
Proteine fibrose
Le proteine fibrose svolgono principalmente funzioni meccaniche e strutturali, fornendo supporto alle cellule e all’intero organismo.
Queste proteine sono insolubili in acqua perché contengono un’alta percentuale di amminoacidi idrofobici, sia al loro interno che sulla superficie. La presenza di amminoacidi idrofobici sulla superficie facilita il loro assemblaggio in strutture sopramolecolari altamente ordinate. In questo contesto, va notato che le loro catene polipeptidiche formano lunghi filamenti o fogli in cui, nella maggior parte dei casi, è presente un solo tipo di struttura secondaria ripetitiva.
Nei vertebrati, le proteine fibrose forniscono protezione esterna, sostegno e forma. Grazie alle loro proprietà strutturali, garantiscono flessibilità e/o resistenza meccanica.
Alcune proteine fibrose, come le α-cheratine, vengono idrolizzate solo parzialmente nell’intestino.
Di seguito sono descritti alcuni esempi rappresentativi di proteine fibrose.
Fibroina
La fibroina è prodotta dai ragni e dagli insetti. Un esempio è la fibroina sintetizzata dal baco da seta Bombyx mori.
Collagene
Il termine collagene non si riferisce a una singola proteina, ma a una famiglia di proteine strutturalmente correlate (almeno 29 tipi diversi) che costituiscono il principale componente proteico del tessuto connettivo e, più in generale, l’impalcatura extracellulare degli organismi multicellulari. Nei vertebrati, i collageni rappresentano circa il 25−30% del contenuto proteico totale.
I collageni si trovano in vari tessuti e organi, compresi i tendini e la matrice organica delle ossa, dove sono presenti in proporzioni molto elevate, così come nella cartilagine e nella cornea dell’occhio.
In tessuti diversi, i collageni formano organizzazioni sopramolecolari distinte, ciascuna adattata a specifiche esigenze funzionali. Ad esempio, nella cornea, le molecole di collagene sono disposte in una struttura quasi cristallina, rendendo il tessuto praticamente trasparente. Al contrario, nella pelle formano fibre meno intrecciate e orientate in più direzioni, garantendo così resistenza alla trazione.
α-Cheratine
Le α-cheratine costituiscono quasi l’intero peso secco di unghie, artigli, becchi, zoccoli, corna, capelli, lana e gran parte dello strato esterno della pelle.
I diversi gradi di rigidità e flessibilità di queste strutture dipendono dal numero di legami disolfuro che, insieme ad altre forze intermolecolari, contribuiscono alla stabilizzazione della struttura proteica. Per questo motivo, le cheratine della lana, che contengono relativamente pochi legami disolfuro, sono flessibili, morbide ed estensibili, mentre le cheratine presenti negli artigli e nei becchi sono ricche di legami disolfuro e quindi molto più rigide.
Elastina
L’elastina è una proteina fibrosa che conferisce elasticità alla pelle e ai vasi sanguigni. Questa proprietà deriva dalla sua struttura a spirale casuale, che differisce notevolmente dalle strutture più ordinate delle α-cheratine e dei collageni.
Nota: i vari tipi di collagene hanno un basso valore nutrizionale perché sono carenti di diversi amminoacidi essenziali. In particolare, sono privi di triptofano e contengono basse quantità di altri amminoacidi essenziali. La gelatina utilizzata nella preparazione degli alimenti è un derivato del collagene.
Proteine globulari
La maggior parte delle proteine appartiene a questa classe.
Le proteine globulari possiedono una struttura compatta, approssimativamente sferica, più complessa di quella delle proteine fibrose. Oltre agli elementi della struttura secondaria, presentano motivi e domini ben definiti, nonché livelli di organizzazione terziari e, in molti casi, quaternari.
Sono generalmente solubili in acqua; tuttavia, alcune proteine globulari sono incorporate nelle membrane biologiche come
proteine transmembrana e quindi operano in un ambiente idrofobico.
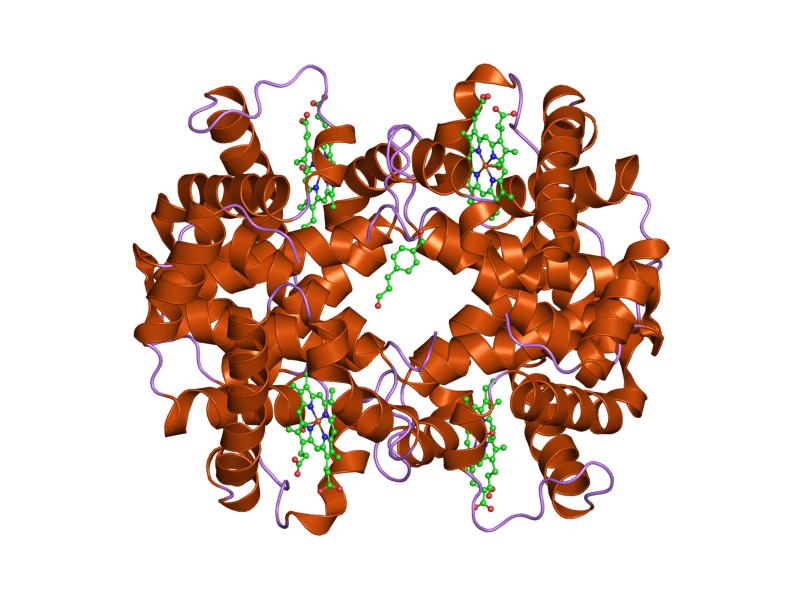
A differenza delle proteine fibrose, che svolgono principalmente funzioni strutturali e meccaniche, le proteine globulari svolgono una vasta gamma di ruoli biologici, tra cui:
- catalisi enzimatica;
- regolazione ormonale;
- trasporto di membrana e attività recettoriale;
- trasporto di trigliceridi e acidi grassi, che sono classi di lipidi, nonché di ossigeno nel sangue;
- difesa immunitaria, come nel caso delle immunoglobuline (anticorpi);
- immagazzinamento di nutrienti nei cereali e nei legumi.
Esempi di proteine globulari sono la mioglobina, l’emoglobina e il citocromo c.
A livello intestinale, la maggior parte delle proteine globulari di origine animale viene quasi completamente idrolizzate nei loro amminoacidi costituenti.
Classificazione delle proteine in base alle funzioni biologiche
L’ampia gamma di funzioni svolte dalle proteine deriva sia dal ripiegamento della catena polipeptidica, che ne determina la struttura tridimensionale, sia dalla presenza di numerosi gruppi funzionali nelle catene laterali degli amminoacidi, quali tioli, gruppi ossidrilici, tioeteri, carbossiammidi, gruppi carbossilici e vari gruppi basici.
Da un punto di vista funzionale, le proteine possono essere classificate in diversi gruppi.
Enzimi
Negli organismi viventi, quasi tutte le reazioni biochimiche sono catalizzate da proteine specifiche note come enzimi. Queste proteine mostrano un’efficienza catalitica molto elevata, aumentando la velocità delle reazioni a cui partecipano di almeno un fattore 106. Di conseguenza, la vita come la conosciamo non potrebbe esistere senza la loro attività catalitica.
Quasi tutti gli enzimi conosciuti, comprese le migliaia presenti nel corpo umano, sono proteine, ad eccezione di alcune molecole di RNA catalitiche note come ribozimi (enzimi dell’acido ribonucleico).
Proteine di trasporto
Molte piccole molecole organiche e inorganiche vengono trasportate nel flusso sanguigno e nei fluidi extracellulari, attraverso le membrane cellulari e, all’interno delle cellule, da un compartimento all’altro da specifiche proteine di trasporto.
Alcuni esempi sono:
- l’emoglobina, che trasporta l’ossigeno dai polmoni ai tessuti;
- la transferrina, che trasporta il ferro nel sangue;
- le proteine di trasporto di membrana;
- le proteine leganti gli acidi grassi (FABP), che sono coinvolte nel trasporto intracellulare degli acidi grassi;
- le proteine delle lipoproteine plasmatiche, complessi macromolecolari di proteine e lipidi responsabili del trasporto dei trigliceridi, che altrimenti sarebbero insolubili in acqua;
- l’albumina, che trasporta nel sangue gli acidi grassi liberi, la bilirubina, gli ormoni tiroidei e alcuni farmaci, come l’aspirina e la penicillina.
Molte di queste proteine svolgono anche un ruolo protettivo, poiché le molecole legate, come gli acidi grassi, possono essere dannose per l’organismo quando presenti in forma libera.
Proteine di riserva
Esempi di proteine di riserva includono:
- ferritina, che immagazzina ferro all’interno delle cellule in forma non tossica;
- caseine del latte, che fungono da riserva di amminoacidi nel latte;
- fosvitina del tuorlo d’uovo, che contiene elevate quantità di fosforo;
- prolamine e gluteline, che sono le principali proteine di riserva dei cereali.
Supporto meccanico
Le proteine svolgono un ruolo fondamentale nella stabilizzazione di molte strutture biologiche. Ne sono un esempio le α-cheratine, il collagene e l’elastina. Lo stesso citoscheletro, che costituisce l’impalcatura strutturale della cellula, è composto da proteine.
Generazione di movimento
Alcune proteine sono responsabili della generazione del movimento, tra cui:
- la contrazione delle fibre muscolari, di cui l’actina e la miosina sono i componenti principali;
- la propulsione degli spermatozoi e dei microrganismi tramite i flagelli;
- la separazione dei cromosomi durante la mitosi.
Trasmissione nervosa
Alcune proteine sono coinvolte nella trasmissione nervosa. Un esempio è il recettore dell’acetilcolina situato nelle sinapsi.
Controllo dello sviluppo e della differenziazione
Diverse proteine partecipano alla regolazione dell’espressione genica e della differenziazione cellulare. Un esempio è il fattore di crescita nervoso (NGF), scoperto da Rita Levi-Montalcini, che svolge un ruolo chiave nella formazione delle reti neurali.
Ormoni
Molti ormoni sono proteine. Queste molecole regolatorie controllano numerose funzioni cellulari, dal metabolismo alla riproduzione. Ne sono esempi l’insulina, il glucagone e la tireotropina o ormone tireostimolante (TSH).
Protezione dagli agenti nocivi
Gli anticorpi sono glicoproteine che riconoscono gli antigeni espressi sulla superficie di virus, batteri e altri agenti infettivi. L’interferone, il fibrinogeno e i fattori di coagulazione del sangue sono altri membri di questo gruppo funzionale.
Riserva di energia
Le proteine, e in particolare gli amminoacidi che le costituiscono, rappresentano un’importante riserva energetica, seconda per dimensioni solo al tessuto adiposo. In determinate condizioni, come il digiuno prolungato, il catabolismo proteico può diventare essenziale per la sopravvivenza. Tuttavia, una riduzione della massa proteica corporea superiore al 30% porta a una grave compromissione della contrazione dei muscoli respiratori, della funzione immunitaria e della funzione degli organi, condizioni incompatibili con la vita. Per questo motivo, le proteine costituiscono una fonte di energia estremamente preziosa, sebbene critica.
Classificazione delle proteine in base alla solubilità
Un altro criterio comunemente utilizzato per la classificazione delle proteine si basa sulla loro solubilità in diversi solventi. La solubilità delle proteine dipende da diversi fattori, tra cui la composizione amminoacidica, la struttura tridimensionale e le interazioni con l’acqua o altri solventi. Per questo motivo, proteine con proprietà strutturali e chimiche diverse mostrano comportamenti di solubilità notevolmente diversi.
Una classificazione basata sulla solubilità è particolarmente utile dal punto di vista sperimentale ed è stata ampiamente applicata, soprattutto nello studio delle proteine vegetali. Tuttavia, gli stessi principi possono essere estesi alle proteine in generale.
In base alla loro solubilità, le proteine possono essere suddivise in diversi gruppi.
Proteine idrosolubili
Queste proteine sono solubili in acqua pura o in soluzioni acquose diluite. Sono tipicamente proteine globulari con un’alta percentuale di amminoacidi polari e carichi esposti sulla superficie. Molti enzimi, ormoni e proteine di trasporto appartengono a questo gruppo. L’albumina sierica è un noto esempio di proteina idrosolubile.
Proteine solubili in soluzioni saline
Alcune proteine sono insolubili in acqua pura, ma diventano solubili in soluzioni saline diluite. La loro solubilità è favorita dalla presenza di ioni, che riducono le interazioni elettrostatiche tra le molecole proteiche. Questo gruppo comprende molte globuline presenti sia nei tessuti animali che in quelli vegetali.
Proteine solubili in alcol
Un altro gruppo di proteine è insolubile in acqua e soluzioni saline, ma solubile in soluzioni acquose alcoliche, tipicamente a una concentrazione di circa il 70% di etanolo. Queste proteine sono generalmente ricche di amminoacidi idrofobici e si trovano principalmente nei semi delle piante, dove fungono da proteine di riserva.
Proteine solubili in soluzioni acide o alcaline
Alcune proteine sono insolubili in acqua, soluzioni saline e alcoliche, ma diventano solubili in soluzioni acide o alcaline diluite. Queste proteine possiedono spesso forti interazioni intermolecolari che possono essere interrotte solo in condizioni di pH estreme.
Classificazione di Osborne delle proteine vegetali
Nel 1924, il chimico americano Thomas Burr Osborne, considerato il fondatore della chimica delle proteine vegetali, propose una classificazione delle proteine vegetali basata sulla loro solubilità in diversi solventi. Questa classificazione, ancora ampiamente utilizzata, divide le proteine vegetali in quattro famiglie:
- albumine, solubili in acqua;
- globuline, solubili in soluzioni saline diluite (ad esempio, l’avenalina dell’avena);
- prolamine, solubili in soluzioni acquose alcoliche ma insolubili in acqua e alcol assoluto; questo gruppo include le gliadine, che insieme alle glutenine costituiscono il glutine;
- gluteline, solubili solo in soluzioni acide o alcaline diluite.
Questa classificazione rimane particolarmente utile per lo studio delle proteine di riserva dei semi.
Bibliografia
- Alberts B., Johnson A., Lewis J., Morgan D., Raff M., Roberts K., Walter P. Molecular biology of the cell. 7th Edition. Garland Science, Taylor & Francis Group, 2022.
- Berg J.M., Tymoczko J.L., Gregory J.G. Jr, Stryer L. Biochemistry. 9th Edition. W.H. Freeman and Company, 2019.
- Branden C., Tooze J. Introduction to protein structure. 2nd Edition. Garland Science, 1999. doi:10.1201/9781136969898
- Garrett R.H., Grisham C.M. Biochemistry. 7th Edition. Cengage Learning, 2023.
- Heilman D., Woski S., Voet D., Voet J.G., Pratt C.W. Fundamentals of biochemistry: life at the molecular level. 6th Edition. Wiley, 2023.
- Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 8th Edition. W.H. Freeman and Company, 2021.
- Osborne T.B. The vegetable proteins. 2nd Edition. London: Longmans, Green and Co., 1924
- Petsko G.A., Ringe D. Protein structure and function. Oxford University Press, 2008.
- Rodwell V.W., Bender D.A., Botham K.M., Kennelly P.J., Weil P.A. Harper’s illustrated biochemistry. 31st Edition. McGraw-Hill, 2018.