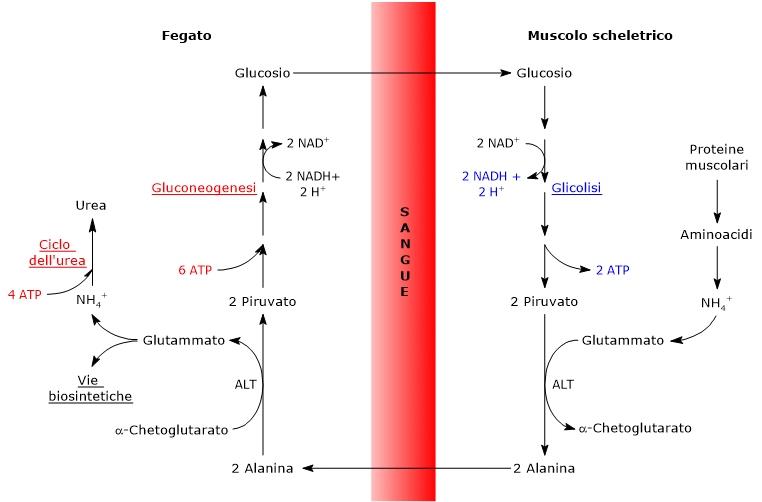
Il ciclo glucosio-alanina, anche detto ciclo di Cahill, proposto per la prima volta tra il 1969 e il 1970 da Mallette, Exton e Park, e Felig e collaboratori, consiste in una serie di reazioni attraverso le quali i tessuti extraepatici, come ad esempio il muscolo scheletrico, esportano al fegato piruvato, la base coniugata dell’acido piruvico, e gruppi amminici in forma di alanina, e ricevono, attraverso il circolo sanguigno, glucosio prodotto nel fegato.[1][2]
Di seguito ne sono riassunte le tappe.
- Quando nei tessuti extraepatici gli amminoacidi sono utilizzati a fini energetici, il piruvato, prodotto dal glucosio attraverso la glicolisi, funge da accettore del loro gruppo amminico, formando alanina, un aminoacido non essenziale.
- L’alanina diffonde nel circolo sanguigno, grazie al quale raggiunge il fegato.
- Nel fegato, il gruppo amminico dell’alanina viene trasferito all’α-chetoglutarato a dare rispettivamente piruvato e glutammato.
- Il glutammato cede per la maggior parte il gruppo amminico al ciclo dell’urea, mentre in parte funge da donatore di azoto in molti processi biosintetici.
Il piruvato entra nella gluconeogenesi e viene utilizzato per la produzione di glucosio. - Il glucosio neoformato diffonde dall’epatocita nel circolo sanguigno e raggiunge i tessuti periferici dove, grazie alla glicolisi, può essere convertito in piruvato, di nuovo disponibile per accettare il gruppo amminico degli amminoacidi liberi, chiudendo così il ciclo.
Il ciclo glucosio-alanina fornisce quindi un collegamento tra il metabolismo dei carboidrati e quello degli amminoacidi.[3]
In breve:
Glucosio → Piruvato → Alanina → Piruvato → Glucosio
Il ciclo glucosio-alanina esiste non solo tra il muscolo scheletrico, il primo tra i tessuti in cui fu osservato, e il fegato, ma coinvolge anche altre cellule e tessuti extraepatici tra cui le cellule del sistema immunitario, ad esempio gli organi linfoidi.[4]
Questo ciclo presenta alcune somiglianze funzionali con il ciclo di Cori, che anch’esso comporta il trasporto di un composto a tre atomi di carbonio dai tessuti periferici al fegato per la rigenerazione del glucosio. Tuttavia, mentre nel ciclo di Cori è il lattato a fungere da navetta, nel ciclo glucosio-alanina è l’amminoacido alanina a trasportare non solo il carbonio, ma anche l’azoto, mettendo così in relazione il metabolismo energetico con quello dell’azoto.[3]
Indice
- Via metabolica
- Funzioni
- Costo energetico del ciclo glucosio-alanina
- Analogie con il ciclo di Cori
- Differenze con il ciclo di Cori
- Bibliografia
Via metabolica
L’analisi successiva verrà fatta considerando il ciclo tra muscolo scheletrico e fegato.
Le proteine, sia intracellulari che extracellulari, sono continuamente idrolizzate nei loro amminoacidi costituenti e risintetizzate; e la velocità con cui avvengono i due processi è tale da evitare una perdita netta di massa magra dall’organismo.[5]
Tuttavia, in condizioni cataboliche, come nel digiuno o nell’esercizio intenso e prolungato, la velocità con cui avviene l’idrolisi delle proteine muscolari supera quella della loro sintesi de novo.[3] Questo porta al rilascio di amminoacidi, alcuni dei quali vengono utilizzati per la produzione di energia, mentre altri sono dirottati verso la gluconeogenesi. L’ossidazione degli scheletri carboniosi degli amminoacidi, in particolare degli amminoacidi a catena ramificata (BCAA) come leucina, isoleucina e valina, può rappresentare una fonte energetica significativa per il tessuto muscolare. In base ai loro percorsi catabolici, questi e altri amminoacidi vengono classificati come glucogenici o chetogenici, a seconda che diano origine a substrati per la gluconeogenesi o per la sintesi di corpi chetonici, rispettivamente.[6] Ad esempio, dopo circa 90 minuti dall’inizio di un esercizio fisico intenso, l’ossidazione intramuscolare degli amminoacidi fornisce il 10–15% dell’energia necessaria alla contrazione.[7]
L’utilizzazione degli scheletri carboniosi degli amminoacidi a fini energetici implica la rimozione del loro gruppo amminico, e quindi il successivo smaltimento di tale azoto in una forma non tossica.[8]
La rimozione del gruppo amminico avviene attraverso reazioni di transaminazione che possono essere schematizzate come segue:
α-Chetoacido + Aminoacido ⇄ Nuovo aminoacido + Nuovo α-chetoacido
Tali reazioni, catalizzate da enzimi detti amminotransferasi o transaminasi (EC 2.6.1-) sono liberamente reversibili.[9]
Gli amminoacidi ramificati, ad esempio, trasferiscono il gruppo amminico all’α-chetoglutarato (anche detto acido 2-ossoglutarico), a dare glutammato e l’α-chetoacido derivato dall’amminoacido stesso, in una reazione catalizzata dalla aminotransferasi a catena ramificata (EC 2.6.1.42).[10]
Ciclo glucosio-alanina nel muscolo scheletrico
Nel muscolo scheletrico, il glutammato prodotto potrà accettare un altro gruppo amminico a dare glutammina, per molti tessuti e organi, come ad esempio il cervello, la principale forma di trasporto interorgano dell’azoto.[11] La reazione è catalizzata dall’enzima citosolico glutammina sintetasi (EC 6.3.1.2) e consuma un ATP.
Glutammato + NH4+ + ATP → Glutammina + ADP + Pi
Ciò tuttavia comporterebbe l’uscita dal ciclo glucosio-alanina.[9]
In alternativa, e a differenza di quanto accade nella maggior parte degli altri tessuti, il glutammato prodotto potrà partecipare a una reazione di transaminazione catalizzata dalla alanina aminotransferasi (ALT; EC 2.6.1.2), enzima presente nella maggior parte dei tessuti animali e vegetali. In tale reazione il glutammato dona il gruppo amminico al piruvato, derivante dalla glicolisi, a dare alanina e α-chetoglutarato:[12]
Piruvato + Glutammato ⇄ Alanina + α-Chetoglutarato
L’alanina prodotta e quella derivante dalla degradazione delle proteine, e le proteine muscolari ne sono piuttosto ricche, può lasciare la cellula ed essere veicolata dal circolo ematico al fegato, trasportandovi quindi il gruppo amminico.[13]
Inoltre, la velocità con cui l’alanina formata per transaminazione dal piruvato viene trasferita in circolo è proporzionale alla produzione intracellulare del piruvato.[14]
Nota: alanina e glutammina sono le principali fonti di azoto e carbonio nel metabolismo interorgano degli amminoacidi.[3]
Ciclo glucosio-alanina nel fegato
Una volta nel fegato si verifica una transaminazione catalizzata dalla alanina aminotransferasi epatica, in cui l’alanina, il principale amminoacido gluconeogenico, funge da donatore del gruppo amminico, e l’α-chetoglutarato da chetoacido accettore.[15] I prodotti della reazione sono il piruvato, ossia lo scheletro carbonioso dell’alanina, e il glutammato.
Alanina + α-Chetoglutarato ⇄ Piruvato + Glutammato
Il glutammato, nella reazione catalizzata dalla glutammato deidrogenasi (EC 1.4.1.2), enzima presente nella matrice mitocondriale, rilascia ione ammonio, che entra nel ciclo dell’urea, e una molecola di α-chetoglutarato, che può entrare nel ciclo dell’acido citrico. Questa reazione rappresenta processo anaplerotico che lega il metabolismo degli amminoacidi con il ciclo dell’acido citrico.[16]
Glutammato + H2O + NAD+ ⇄ α-Chetoglutarato + NH4+ + NADH + H+
Tuttavia il glutammato potrà entrare anche nella reazioni di transaminazione, catalizzata dalla aspartato amminotransferasi (EC 2.6.1.1), con l’ossalacetato a dare aspartato e α-chetoglutarato.[17] L’aspartato è uno degli amminoacidi coinvolti nella produzione di urea attraverso il ciclo dell’urea, ma può essere utilizzato pure nella sintesi delle purine e pirimidine.[18]
Glutammato + Ossalacetato ⇄ Aspartato + α-Chetoglutarato
Anche il piruvato prodotto potrà seguire destini metabolici differenti:
- può essere ossidato per la produzione di ATP, e quindi uscire dal ciclo glucosio-alanina;
- può entrare nella via gluconeogenetica, e dunque proseguire nel ciclo glucosio-alanina.[19]
Il glucosio prodotto verrà rilasciato dall’epatocita e attraverso il circolo ematico distribuito ai vari tessuti che lo richiedono, tra cui il muscolo scheletrico, dove viene utilizzato per la produzione di piruvato, di nuovo disponibile per accettare il gruppo amminico del glutammato, chiudendo così il ciclo.[20]
Transaminasi
Come detto in precedenza, la rimozione del gruppo amminico degli amminoacidi avviene in reazioni di transaminazione, catalizzate da enzimi detti amminotransferasi o transaminasi.[12]
Sono enzimi citosolici, presenti in tutte le cellule e particolarmente abbondanti nel fegato, rene, intestino e muscolo, la maggior parte dei quali richiede come coenzima il piridossal fosfato (PLP), la forma attiva della vitamina B6 (piridossina). Il coenzima è legato strettamente al sito attivo dell’enzima.[13]
Nelle reazioni di transaminazione il gruppo amminico degli amminoacidi liberi, con l’esclusione della treonina e lisina, è incanalato verso un numero ristretto di chetoacidi, in particolare piruvato, ossalacetato e α-chetoglutarato.[3]
Le cellule contengono diversi tipi di amminotransferasi: molte sono specifiche per l’α-chetoglutarato come accettore del gruppo amminico, ma differiscono nella specificità per l’amminoacido, da cui prendono parte del nome. Esempi sono:
- le già citate alanina aminotransferasi, anche detta alanina transaminasi o glutammico piruvico transferasi (GPT);
- l’aspartato aminotransferasi (AST) o glutammico ossalacetico transaminasi (GOT) (EC 2.6.1.1).[9]
Va sottolineato che nelle reazioni di transaminazione non si verifica alcuna deaminazione netta, nessuna perdita di gruppi amminici, in quanto il chetoacido accettore viene amminato e l’amminoacido deaminato.[12]
Funzioni
Il ciclo glucosio-alanina svolge diverse importanti funzioni fisiologiche.
- Trasporta azoto in una forma non tossica dai tessuti periferici al fegato.[8]
- Trasporta al fegato piruvato, un substrato gluconeogenico.[8]
- Rimuove piruvato dai tessuti periferici nei quali è così possibile ottenere una maggior produzione di ATP dal glucosio. Infatti il NADH prodotto durante la glicolisi può entrare nei mitocondri ed essere ossidato attraverso la fosforilazione ossidativa.[13]
- Concorre a mantenere nell’epatocita una concentrazione relativamente alta di alanina, tale da inibire la degradazione delle proteine.[15]
- Può avere un ruolo nella difesa dell’ospite nei confronti delle malattie infettive.[21]
| Funzione | Descrizione |
|---|---|
| Trasporto dell’azoto | Trasporta in modo sicuro l’azoto dai tessuti periferici al fegato sotto forma di alanina. |
| Trasporto del piruvato | Consegna il piruvato (un substrato gluconeogenico) al fegato per la produzione di glucosio. |
| Ottimizzazione della sintesi dell’ATP | Migliora la resa in ATP nei tessuti periferici permettendo l’ossidazione completa del NADH glicolitico nei mitocondri. |
| Effetto di risparmio proteico | Aiuta a mantenere alti livelli di alanina negli epatociti, potenzialmente riducendo la degradazione proteica epatica. |
| Sostegno alla difesa dell’ospite | Potrebbe contribuire alla risposta immunitaria durante le infezioni (meccanismo in studio). |
| Assenza di guadagno netto di glucosio | Il ciclo non comporta una sintesi netta di glucosio. |
Infine è importante sottolineare che nel ciclo glucosio-alanina non c’è sintesi netta di glucosio.[3]
Costo energetico del ciclo glucosio-alanina
Al pari del ciclo di Cori, anche il ciclo glucosio-alanina ha un costo energetico, che corrisponde a 3-5 molecole di ATP per ciclo.[22]
La parte del ciclo che si svolge nei tessuti periferici comporta la produzione di 5–7 molecole di ATP per molecola di glucosio:
- 2 ATP sono prodotti dalla glicolisi;
- 3–5 ATP derivano dal trasferimento degli elettroni dal NADH/FADH2 alla catena di trasporto degli elettroni.
La parte del ciclo che si svolge nel fegato comporta invece una spesa energetica pari a 10 ATP:
- 6 ATP sono consumati nel corso della gluconeogenesi;
- 4 ATP sono necessari per il ciclo dell’urea per ogni molecola di urea prodotta.
Il ciclo glucosio-alanina, al pari del ciclo di Cori, sposta parte del carico metabolico dai tessuti extraepatici al fegato. Tuttavia il prezzo pagato dal fegato è ampiamente giustificato dai vantaggi che il ciclo apporta all’intero organismo in quanto consente, in particolari condizioni (ad esempio l’esercizio fisico prolungato o il digiuno), un efficiente catabolismo delle proteine nei tessuti extraepatici. Questo a sua volta permette di ottenere substrati per la gluconeogenesi come anche l’utilizzazione a fini energetici degli aminoacidi nei tessuti extraepatici.[3]
Analogie con il ciclo di Cori
Tra i due cicli esistono alcune analogie di seguito elencate.
- Il ciclo di Cahill in parte si sovrappone al ciclo di Cori quando il piruvato viene convertito in glucosio e lo stesso trasportato ai tessuti extraepatici, dove attraverso la via glicolitica rigenera piruvato.[3]
- L’ingresso nella gluconeogenesi epatica è simile per i due cicli: sia l’alanina che il lattato sono infatti convertiti in piruvato.[9]
- Al pari del ciclo di Cori, anche il ciclo glucosio-alanina si estende attraverso tipi cellulari differenti, al contrario di quanto accade con vie metaboliche come la glicolisi, il ciclo dell’acido citrico o la gluconeogenesi che sono confinate all’interno di singole cellule.[23]
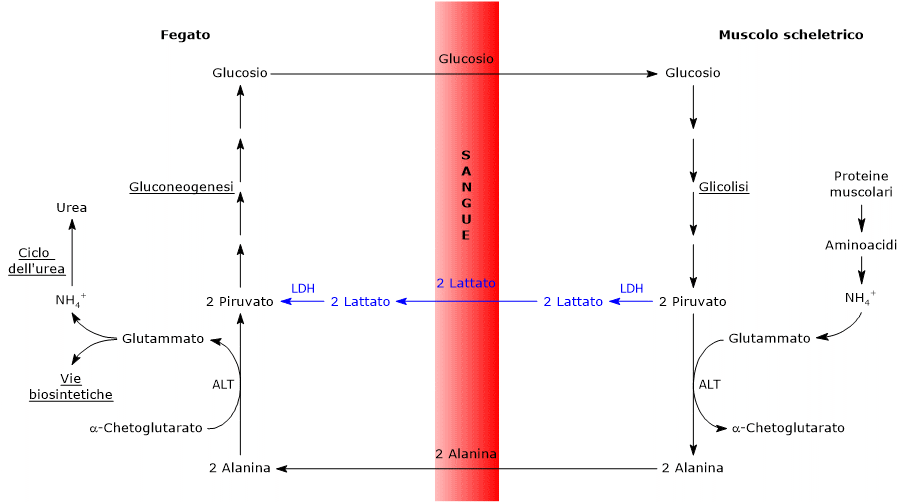
Differenze con il ciclo di Cori
Di seguito, alcune differenze tra i due cicli.
- La principale differenza riguarda l’intermedio a tre atomi di carbonio che dai tessuti periferici raggiunge il fegato: il lattato nel il ciclo di Cori e l’alanina nel ciclo glucosio-alanina.[15]
- Un’altra differenza riguarda il destino del NADH prodotto dalla glicolisi nei tessuti periferici.
- Nel ciclo di Cori il coenzima funge da donatore di agenti riducenti nella riduzione del piruvato a lattato, nella reazione catalizzata dalla lattato deidrogenasi (EC 1.1.1.27).
- Nel ciclo glucosio-alanina tale riduzione non si verifica e gli elettroni del NADH potranno essere trasportati all’interno del mitocondrio dai sistemi navetta del malato-aspartato o del glicerolo-3-fosfato, generando NADH la prima navetta e FADH2 l’altra, da cui si otterranno rispettivamente 2,5 e 1,5 molecole di ATP.[23]
- Infine, dal punto precedente emerge che, a differenza del ciclo di Cori, per il ciclo glucosio-alanina è richiesta nei tessuti periferici anche la presenza di ossigeno e mitocondri.[11]
| Caratteristica | Ciclo di Cori | Ciclo del glucosio-alanina |
|---|---|---|
| Composto a 3 atomi di carbonio trasportato al fegato | Lattato | Alanina |
| Origine del composto a 3 atomi di carbonio | Riduzione del piruvato da parte del NADH | Transaminazione del piruvato con glutammato |
| Utilizzo del NADH nei tessuti periferici | Consumato per ridurre il piruvato a lattato | Trasferito nei mitocondri tramite navette |
| Richiesta di ossigeno e mitocondri | No | Sì |
| Trasporto di azoto | No | Trasporta gruppi amminici (come alanina) al fegato |
| Avviene tra tipi cellulari diversi | Sì | Sì |
| Ingresso nella gluconeogenesi | Lattato → Piruvato | Alanina → Piruvato |
| Costo energetico nel fegato | Elevato (gluconeogenesi) | Elevato (gluconeogenesi + ciclo dell’urea) |
Bibliografia
- ^ Felig P., Pozefsk T., Marlis E., Cahill G.F. Alanine: key role in gluconeogenesis. Science 1970;167(3920):1003-1004. doi:10.1126/science.167.3920.1003
- ^ Mallette L.E., Exton J.H., and Park C.R. Control of gluconeogenesis from amino acids in the perfused rat liver. J Biol Chem 1969;244(20):5713-5723. doi:10.1016/S0021-9258(18)63618-X
- ^ a b c d e f g Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 8th Edition. W.H. Freeman and Company, 2021.
- ^ Zhao H., Raines L.N., Huang S.C. Carbohydrate and amino acid metabolism as hallmarks for innate immune cell activation and function. Cells 2020;9(3):562. doi:10.3390/cells9030562
- ^ Lecker S.H., Goldberg A.L. and Mitch W.E. Protein degradation by the ubiquitin–proteasome pathway in normal and disease states. J Am Soc Nephrol 2006;17(7):1807-1819.doi:10.1681/ASN.2006010083
- ^ Rennie M.J., Tipton K.D. Protein and amino acid metabolism during and after exercise and the effects of nutrition. Annu Rev Nutr 2000;20:457-83. doi:10.1146/annurev.nutr.20.1.457
- ^ Witard O.C., Hearris M., Morgan P.T. Protein nutrition for endurance athletes: a metabolic focus on promoting recovery and training adaptation. Sports Med 2025;55(6):1361-1376. doi:10.1007/s40279-025-02203-8
- ^ a b c Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012.
- ^ a b c d Voet D. and Voet J.D. Biochemistry. 4th Edition. John Wiley J. & Sons, Inc. 2011.
- ^ Nong X., Zhang C., Wang J., Ding P., Ji G., Wu T. The mechanism of branched-chain amino acid transferases in different diseases: research progress and future prospects. Front Oncol 2022;12:988290. doi:10.3389/fonc.2022.988290
- ^ a b Wu G. Amino acids: biochemistry and nutrition. CRC Press, 2010.
- ^ a b c Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5th Edition. W. H. Freeman and Company, 2002.
- ^ a b c Rodwell V.W., BenderD.A., BothamK.M., KennellyP.J., WeilP.A. Harper’s Illustrated Biochemistry., 31st Edition. McGraw-Hill, 2018.
- ^ Owen O.E., Morgan A.P., Kemp H.G., Sullivan J.M., Herrera M.G., Cahill G.F. Jr. Brain metabolism during fasting. J Clin Invest 1967;46(10):1589-95. doi:10.1172/JCI105650
- ^ a b c Felig P. The glucose-alanine cycle. Metabolism 1973;22(2):179-207. doi:10.1016/0026-0495(73)90269-2
- ^ Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc. 2009.
- ^ Chandel N.S. Amino acid metabolism. Cold Spring Harb Perspect Biol 2021;13(4):a040584. doi:10.1101/cshperspect.a040584
- ^ Kurmi K., Haigis M.C. Nitrogen metabolism in cancer and immunity. Trends Cell Biol 2020;30(5):408-424. doi:10.1016/j.tcb.2020.02.005
- ^ Gray L.R., Tompkins S.C., Taylor E.B. Regulation of pyruvate metabolism and human disease. Cell Mol Life Sci 2014;71(14):2577-604. doi:10.1007/s00018-013-1539-2
- ^ Petersen K.F., Dufour S., Cline G.W., Shulman G.I. Regulation of hepatic mitochondrial oxidation by glucose-alanine cycling during starvation in humans. J Clin Invest 2019;129(11):4671-4675. doi:10.1172/JCI129913
- ^ Newsholme E.A., Parry-Billings M. Properties of glutamine release from muscle and its importance for the immune system. JPEN J Parenter Enteral Nutr 1990;14(4 Suppl):63S-67S. doi:10.1177/014860719001400406
- ^ Felig P. Amino acid metabolism in man. Annu Rev Biochem 1975;44:933-55. doi:10.1146/annurev.bi.44.070175.004441
- ^ a b Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010.