Il metabolismo del glicogeno si compone di due fasi: una fase anabolica o costruttiva, in cui si verifica la sintesi del glicogeno, e una fase degradativa, detta glicogenolisi, in cui il polisaccaride viene catabolizzato.[1]
La glicogenolisi libera glucosio quando questo è necessario.[2]
Nel fegato, il glicogeno rappresenta una riserva di glucosio che contribuisce alla regolazione della glicemia. La sua degradazione si verifica principalmente:
- durante il digiuno, ad esempio di notte;
- nell’intervallo tra i pasti;
- durante l’attività fisica ad alta intensità.[3]
Negli epatociti, la glicogenolisi è stimolata dal glucagone e dall’adrenalina, inibita dall’insulina, e soggetta anche a regolazione allosterica negativa da parte del glucosio.[4]
Il glicogeno è un’importante riserva di energia per l’attività muscolare. Infatti, la sua degradazione avviene soltanto durante la contrazione, e solo nei muscoli coinvolti nell’attività.
Nella cellula muscolare, la glicogenolisi è stimolata dall’adrenalina e regolata da effettori allosterici sia positivi, AMP e ione calcio (Ca2+), che negativi, ATP e glucosio-6-fosfato (G6P).[5]
Indice
- Reazioni della glicogenolisi
- Prodotti della glicogenolisi
- Regolazione covalente nel muscolo e fegato
- Regolazione allosterica nel muscolo e fegato
- Bibliografia
Reazioni della glicogenolisi
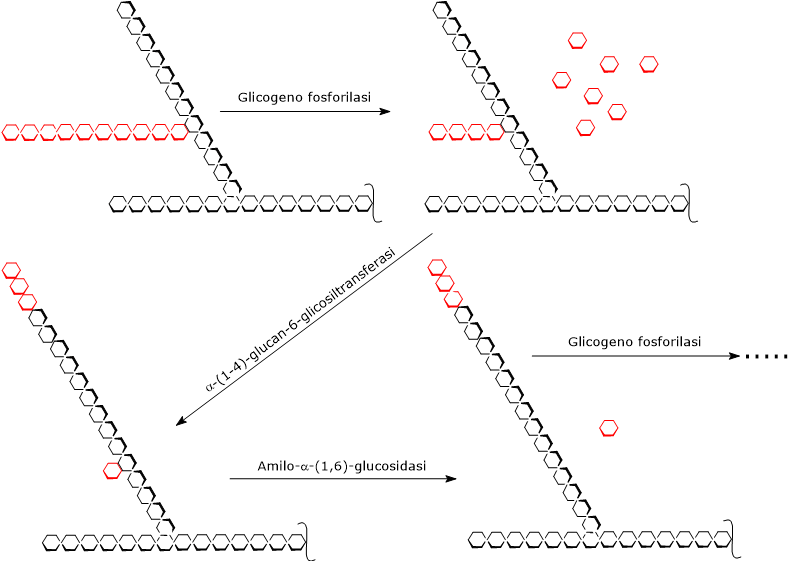
La glicogenolisi inizia per azione dell’enzima glicogeno fosforilasi (EC 2.4.1.1), un omodimero che per la sua attività necessita come cofattore il piridossal-5’-fosfato, un derivato della vitamina B6.
L’enzima catalizza la scissione fosforolitica di un legame glicosidico α-(1,4), con liberazione di una molecola di glucosio alla volta dalle estremità non riducenti delle ramificazioni esterne, ossia le terminazioni con un gruppo 4’-OH libero. Questa reazione, che non consuma ATP ma un fosfato inorganico (Pi), produce glucosio-1-fosfato (G1P).[6]
Glicogeno(n residui di glucosio) + Pi → G1P + Glicogeno(n−1 residui di glucosio)
Nota: nell’intestino tenue l’alfa-amilasi pancreatica (EC 3.2.1.1) catalizza la scissione idrolitica dei legami glicosidici α-(1,4) dell’amido, liberando glucosio.[7]
In vivo, la glicogeno fosforilasi catalizza una fosforolisi irreversibile, reazione particolarmente vantaggiosa per il muscolo, sia scheletrico che cardiaco.
L’irreversibilità è assicurata dal rapporto [Pi]/[G1P] che è di solito maggiore di 100. La reazione è invece facilmente reversibile in vitro.[8]
Durante la glicogenolisi, la glicogeno fosforilasi agisce ripetutamente all’estremità non riducente delle ramificazione, ma la sua attività cessa a quattro residui di distanza dal punto di ramificazione. Questo rappresenta il limite esterno della destrina limite.[5]
A questo punto intervengono in sequenza due attività enzimatiche presenti sulla stessa catena polipeptidica: l’α-(1,4)-glucan-6-glicosiltransferasi (EC 2.4.1.25) e l’amilo-α-(1,6)-glucosidasi (EC 3.2.1.33), anche detto enzima deramificante.
La prima attività trasferisce tre dei quattro residui di glucosio rimasti dalla ramificazione all’estremità non riducente di un’altra ramificazione, lasciando un solo residuo di glucosio legato alla catena principale da un legame glicosidico α-(1,6).
La seconda attività idrolizza questo legame α-(1,6) glicosidico, liberando glucosio e producendo una catena non ramificata formata da unità di glucosio legate da legami glicosidici α-(1,4).[9][10]
Eliminata la ramificazione, la glicogeno fosforilasi riprende la sua attività sino alla successiva destrina limite.[4]
Prodotti della glicogenolisi
I prodotti delle reazioni catalizzate dalla glicogeno fosforilasi e dalle due attività dell’enzima deramificante, l’α-(1,4)-glucan-6-glicosiltransferasi e l’amilo-α-(1,6)-glucosidasi, sono:
- glucosio-1-fosfato, che rappresenta circa il 90% delle unità di glucosio rilasciate;
- una piccola quantità di glucosio libero, circa il 10%, corrispondente ai residui legati tramite legame glicosidico α-(1,6). Nel muscolo, l’attività della esochinasi (EC 7.1.1) è così elevata che il glucosio libero è immediatamente fosforilato a glucosio-6-fosfato, dunque attivato e metabolizzato nella cellula;
- una molecola di glicogeno con dimensioni e ramificazioni minori.[4]
Metabolismo del G1P nel muscolo e fegato
Il glucosio-1-fosfato è una molecola dotata di carica e pertanto intrappolata all’interno della cellula.
È convertito in glucosio-6-fosfato nella reazione catalizzata dalla fosfoglucomutasi (EC 5.4.2.2), lo stesso enzima che interviene anche nella sintesi del glicogeno convertendo il glucosio-6-fosfato a glucosio-1-fosfato.
L’enzima catalizza una reazione reversibile, la cui direzione dipende dalle concentrazioni relative delle due molecole. In questo caso il gruppo fosfato viene trasferito dal C1 al C6.[8]
G1P ⇄ G6P
Nel muscolo e nella maggior parte degli altri organi e tessuti, il glucosio derivante dalla glicogenolisi entra nella via glicolitica come G6P, bypassando così il passaggio iniziale di attivazione catalizzato della esochinasi.
Ne consegue che la glicogeno fosforilasi, liberando un’unità di glucosio già “attivata”, permette il risparmio di una molecola di ATP.
Una molecola di ATP è richiesta per produrre un successivo intermedio glicolitico, il fruttosio-1,6-bisfosfato.
In questo modo si conserva una parte dell’energia di attivazione spesa per la sintesi del glicogeno.
Di conseguenza, il guadagno netto per molecola di glucosio convertito a lattato nella glicolisi sarà non di due ma di tre molecole di ATP, un vantaggio per il muscolo durante l’esercizio.
L’equazione complessiva è:
Glicogeno(n residui di glucosio) + 3 ADP + 3 Pi → Glicogeno(n−1 residui di glucosio) + 2 Lattato + 3 ATP
Nel fegato, il glucosio-6-fosfato proveniente dalla glicogenolisi è defosforilato dalla glucosio-6-fosfatasi (EC 3.1.3.9) e quindi rilasciato nel circolo ematico.
I singoli passaggi che intervengono nella rimozione di una molecola di glucosio in forma fosforilata dal glicogeno sono:[5]
Glicogeno(n residui di glucosio) + Pi → G1P + Glicogeno(n−1 residui di glucosio)
G1P → G6P
G6P + H2O → Glucosio + Pi
L’equazione complessiva è:
Glicogeno(n residui di glucosio) + H2O → Glicogeno(n−1 residui di glucosio) + Glucosio
Regolazione covalente nel muscolo e fegato
La glicogenolisi è soggetta ad un fine controllo attraverso modificazioni sia covalenti che allosteriche di alcuni enzimi chiave, tra cui la fosforilasi chinasi (EC 2.7.11.19), la glicogeno fosforilasi e la proteina fosfatasi 1 (PP1).[6]
Di seguito sono analizzati gli effetti di due ormoni che agiscono attraverso fosforilazione di specifiche proteine bersaglio:
- l’adrenalina o epinefrina, prodotta dalle ghiandole surrenali, agisce sulle cellule epatiche, muscolari e del tessuto adiposo;
- il glucagone, prodotto dalle cellule α del pancreas, agisce sugli epatociti e gli adipociti.
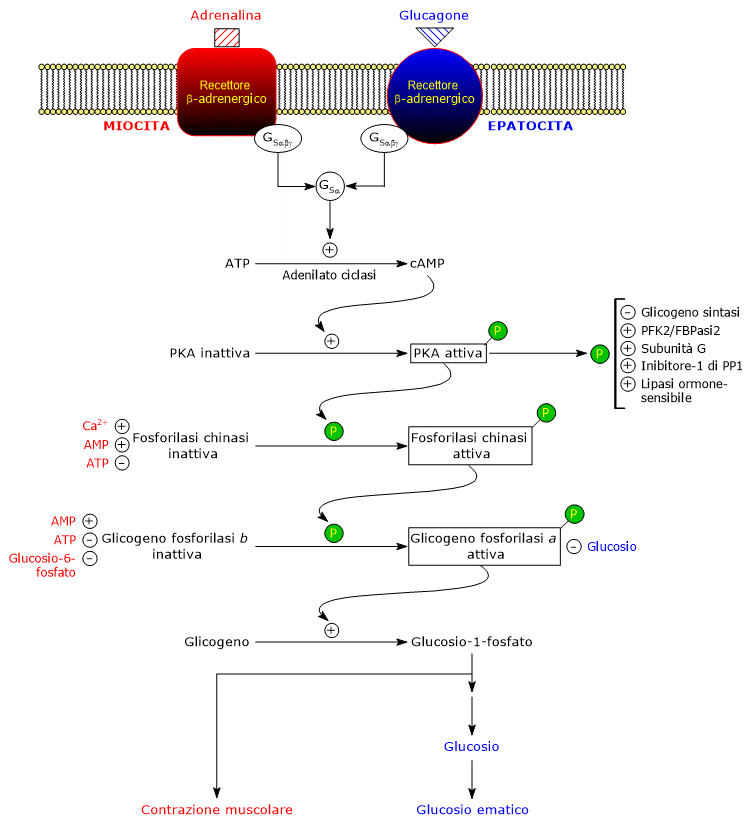
Questi ormoni, legandosi ai rispettivi recettori di membrana, innescano una identica cascata di reazioni intracellulari che amplifica di diversi ordini di grandezza il segnale da essi trasportato, stimolando la glicogenolisi e inibendo la sintesi del glicogeno.[5]
Da notare che anche l’acetilcolina, a seguito del legame al suo specifico recettore presente a livello delle giunzioni neuromuscolari, innesca una cascata di attivazioni simile a quella di adrenalina e glucagone.[11]
Nei paragrafi successivi verranno prese in esame le proteine coinvolte nella cascata di reazioni.
Recettori β-adrenergici
I recettori per l’adrenalina e il glucagone sono proteine integrali di membrana caratterizzate da sette α-eliche transmembrana.
Tali recettori sono definiti “adrenergici”, dal nome dell’ormone adrenalina, e ne esistono quattro sottotipi: α1, α2, β1 e β2. Nella discussione successiva saranno considerati solo i recettori β1 e β2, indicati come recettori β, che agiscono allo stesso modo.[12][13]
I recettori β mediano cambiamenti nel metabolismo energetico, come:
- un aumento della glicogenolisi nelle cellule muscolari ed epatiche;
- un aumento della lipolisi, ossia la demolizione dei trigliceridi, nel tessuto adiposo.[4]
Proteina G stimolatoria
Il legame dell’ormone al suo recettore induce modificazioni conformazionali nella porzione citosolica del recettore stesso, in conseguenza delle quali si modifica la sua interazione con la seconda proteina della cascata: la proteina stimolatoria legante i nucleotidi guaninici, o più semplicemente proteina G stimolatoria (GS).
Si tratta di un eterotrimero formato da tre subunità, indicate come:
- α, la subunità che presenta il sito di legame dei nucleotidi;
- β;
- γ.
Nella forma inattiva, GSαβγ-GDP, l’eterotrimero è associato al recettore β-adrenergico.
Le modificazioni conformazionali subite dal recettore gli consentono di catalizzare la sostituzione del GDP con il GTP nella subunità α di GSαβγ.
Questo scambio porta alla dissociazione del trimero in un dimero βγ inattivo e in un complesso GSα-GTP attivo, che si sposta lungo la superficie interna della membrana plasmatica.
Il complesso GSα-GTP rimane ancorato alla membrana tramite un gruppo palmitoilico legato covalentemente e si muove fino a raggiungere l’adenilato ciclasi (EC 4.6.1.1).[13]
Nota: l’azione di GS ricorda quella delle proteine Ras, un’altra classe di proteine G, che interviene nella trasduzione del segnale trasportato dall’insulina.[14]
Adenilato ciclasi
L’adenilato ciclasi è un enzima integrale di membrana il cui sito catalitico è rivolto verso il lato citosolico della membrana plasmatica.
A seguito del legame con GSα l’enzima passa in forma attiva e catalizza la sintesi dell’AMP ciclico o cAMP dall’ATP, determinando quindi un aumento della concentrazione intracellulare del nucleotide ciclico.
L’attività stimolatoria di GSα è autolimitante in quanto è essa stessa una GTPasi, ossia è capace di idrolizzare il GTP in GDP inattivandosi. Nella forma inattiva, GSα-GDP, GSα si dissocia dalla adenilato ciclasi e si riassocia al dimero Gβγ inattivo. In questo modo l’eterotrimero diventa nuovamente disponibile per interagire con un nuovo complesso ormone-recettore.[13][15]
Protein chinasi A
Il cAMP si va a legare alla protein chinasi cAMP-dipendente o protein chinasi A o PKA (EC 2.7.11.11), attivandola.
La forma inattiva dell’enzima è un tetramero formato da due subunità catalitiche e due regolatorie.
Ognuna delle due subunità regolatorie possiede un dominio autoinibitorio, ossia una regione che va ad occupare il sito di legame per il substrato di ciascuna subunità catalitica.
Il legame di due molecole di cAMP a due siti su ciascuna subunità regolatoria determina nelle stesse una modificazione conformazionale in conseguenza della quale si dissociano dal tetramero, lasciando le due subunità catalitiche in forma attiva.[16]
La forma attiva di PKA catalizza la fosforilazione di specifici residui aminoacidici su diverse proteine, attivandole o inibendone l’attività. Tra le proteine bersaglio si ritrovano:
- glicogeno sintasi (EC 2.4.1.11), inibita;
- lipasi ormone-sensibile (EC 3.1.1.79), attivata;
- fosfofruttochinasi 2/fruttosio-2,6-bisfosfatasi (rispettivamente EC 2.7.1.105 ed EC 3.1.3.46), attivate;
- inibitore-1 e la subunità G (glycogen-binding) della protein fosfatasi 1, attivate;
- fosforilasi chinasi, attivata.[11]
L’emivita del cAMP è molto breve. Il nucleotide ciclico è idrolizzato ad AMP, inattivo come secondo messaggero, nella reazione catalizzata dalla nucleotide ciclico fosfodiesterasi (EC 3.1.4.53).
La caffeina e la teofillina, due metilxantine presenti rispettivamente nel caffè e nel tè, inibiscono l’azione della suddetta fosfodiesterasi, aumentando quindi l’emivita del cAMP, e potenziandone l’effetto.[8][17]
Fosforilasi chinasi
Il passaggio successivo della cascata di attivazioni è operato dalla fosforilasi chinasi.
La proteina è formata da quattro differenti subunità, ognuna presente in quattro copie, a formare un complesso (αβγδ)4.
Le subunità γ hanno attività catalitica, mentre le altre sono regolatorie.
Le subunità α e β vengono fosforilate nel passaggio dalla forma inattiva a quella attiva.[18]
La subunità δ, detta calmodulina, è una proteina regolatoria capace di legare il Ca2+.
Non è esclusiva della fosforilasi chinasi, ma si trova anche in altri enzimi, dove agisce come sensore del Ca2+, rispondendo alle variazioni della sua concentrazione intracellulare e modulando così l’attività delle proteine associate.[4]
Esistono due isoforme della fosforilasi chinasi: una espressa nel muscolo scheletrico e cardiaco, l’altra nel fegato. Le isoforme differiscono per le subunità α e γ, codificate da geni distinti.[19]
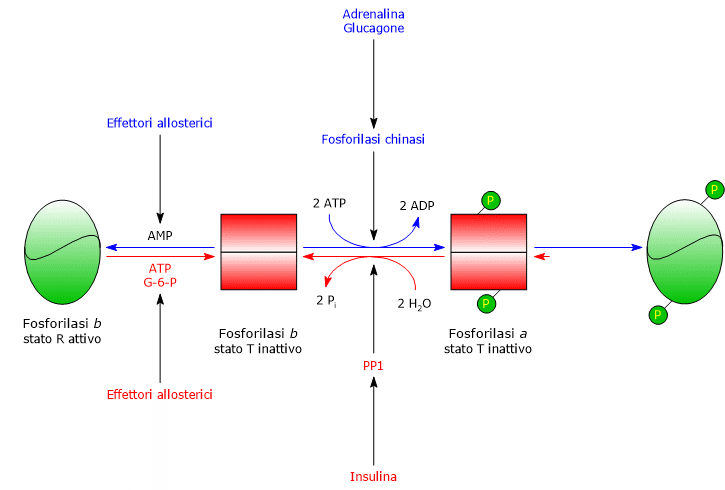
Uno dei principali bersagli della fosforilasi chinasi attivata è la glicogeno fosforilasi, presente in diverse forme isoenzimatiche nei vari tessuti. Essa può esistere in due stati conformazionali in equilibrio:
- T (tense o taut), meno attivo;
- R (relaxed), più attivo e capace di legarsi ai granuli di glicogeno, anche nello stato fosforilato.
La fosforilasi chinasi fosforila un residuo di serina (Ser14) in ciscuna subunità della glicogeno fosforilasi, che in forma defosforilata è quasi interamente nello stato T.
Questa fosforilazione la converte nella forma attiva, prevalentemente nello stato R, innescando la glicogenolisi.
L’enzima fosforilato, detto glicogeno fosforilasi a, è la forma più attiva, mentre quella non fosforilata è la forma b, meno attiva
Entrambe possono essere regolate allostericamente.[11]
Nel muscolo, la glicogenolisi libera glucosio-1-fosfato utilizzato per la contrazione muscolare durante la risposta adrenergica.[19]
Nel fegato, invece, il glucosio prodotto viene rilasciato nel sangue per contrastare l’ipoglicemia segnalata dal glucagone.[5]
Regolazione da parte di PP1 e PKA
Terminata la situazione stressante, PP1 catalizza la rimozione dei gruppi fosfato dalla fosforilasi chinasi e dalla glicogeno fosforilasi a, convertendole così nelle forme inattive.
L’enzima defosforila anche la glicogeno sintasi.[8]
PP1 è formata da una subunità catalitica, di per sé inefficiente in quanto dotata di bassa affinità per le particelle di glicogeno, e dalla subunità G, che appartiene ad una famiglia di proteine che ancorano altre proteine ai granuli di glicogeno, definite in inglese come glycogen-targeting proteins.
Si noti che anche la fosforilasi chinasi, la glicogeno fosforilasi, e la glicogeno sintasi sono ancorate ai granuli di glicogeno da proteine appartenenti a questa famiglia.[20]
PP1 è inibita anche da un’altra proteina detta inibitore 1 di PP1.[21]
Come visto in precedenza, PKA fosforila:
- la subunità G, nella forma fosforilata non è in grado di legarsi alla subunità catalitica di PP1, che quindi a sua volta non è in grado di incontrare i suoi substrati legati al glicogeno (di contro la fosforilazione della subunità G indotta dall’insulina, interessando residui amminoacidici diversi dai precedenti, permette il legame alla subunità catalitica di PP1);
- l’inibitore 1, che in forma fosforilata blocca PP1.
Quindi, il legame dell’ormone al recettore innesca una cascata di reazioni che, tra le altre cose, determina l’inattivazione di PP1. Questo mantiene fosforilate sia la glicogeno fosforilasi, che è nella sua forma attivata, e la glicogeno sintasi, al contrario nella sua forma inattivata. In questo modo si ottimizza il metabolismo dei carboidrati.[5]
Regolazione allosterica nel muscolo e fegato
La glicogenolisi è regolata anche da effettori allosterici sia positivi che negativi, che agiscono su tre enzimi: la fosforilasi chinasi muscolare, la glicogeno fosforilasi epatica e muscolare e PP1, attraverso meccanismi la cui complessità strutturale è stata ben caratterizzata.[22]
Fosforilasi chinasi del muscolo
L’attività dell’enzima è regolata da due effettori allosterici positivi, lo ione calcio e l’AMP, e uno negativo, l’ATP.
Un aumento nella concentrazione intracellulare dello ione calcio è il segnale per la contrazione muscolare. Una volta rilasciato dal reticolo sarcoplasmatico, Ca2+ si lega alla subunità δ, ossia la calmodulina, dell’enzima attivandolo.
L’AMP si accumula nel muscolo in contrazione vigorosa a seguito del consumo di ATP e si lega all’enzima attivandolo.
Al contrario, quando l’ATP è presente in concentrazione elevata, ad esempio quando il muscolo non si sta contraendo, si lega al sito allosterico per l’AMP, inattivando così la chinasi.[11]
Fosforilasi chinasi del fegato
Alcuni ormoni possono agire non solo innescando modificazioni covalenti di proteine bersaglio, ma anche attraverso il rilascio di ioni calcio dal reticolo endoplasmatico.
Nel fegato, l’attività della fosforilasi chinasi è regolata da ormoni che determinano il rilascio di ioni calcio. Esempi sono la vasopressina e l’adrenalina, quest’ultima quando si lega ai recettori α1 adrenergici. Riguardo l’adrenalina, il suo legame a questi recettori attiva una proteina G che stimola la fosfolipasi C-β, che a sua volta scinde il fosfatidilinositolo-4,5-disfosfato (PIP2) in inositolo 1,4,5-trifosfato (IP3) e diacilglicerolo (DAG).
IP3 induce il rilascio di ioni calcio dal reticolo endoplasmatico. Gli ioni calcio legandosi alla subunità δ della fosforilasi chinasi ne determinano l’attivazione.[11]
Glicogeno fosforilasi del muscolo
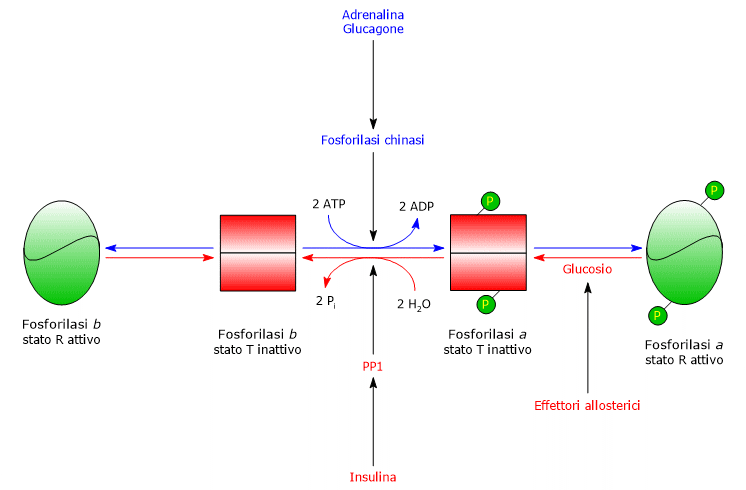
La glicogeno fosforilasi b del muscolo si attiva in presenza di elevate concentrazione di AMP, che, legandosi ad uno specifico sito di legame per i nucleotidi, modifica la struttura quaternaria dell’enzima, spostando l’equilibrio allosterico verso lo stato R, attivo, della forma b.
Al contrario, ATP e G6P, che competono con l’AMP per lo stesso sito di legame per i nucleotidi, agiscono come effettori allosterici negativi, spostando l’equilibrio allosterico verso lo stato T, inattivo, della forma b.
Al contrario, la glicogeno fosforilasi a è attiva, a prescindere dai livelli di AMP, ATP e glucosio-6-fosfato.
Nel muscolo a riposo, la glicogeno fosforilasi è praticamente tutta nella forma b inattiva.[4][23]
La duplice regolazione cui è soggetto l’enzima, covalente e allosterica, assicura che i livelli intracellulari di glucosio siano finemente regolati.
- Se una cellula con un’adeguata carica energetica riceve il segnale ormonale che innesca la cascata di attivazioni, la glicogeno fosforilasi b, inibita dall’ATP e dal glucosio-6-fosfato, rimane nello stato T inattivo finché la carica energetica è alta.
- Quando la carica energetica della cellula è bassa, la glicogeno fosforilasi b, attivata dall’AMP, inizia la glicogenolisi anche in assenza dello stimolo ormonale che induca la sua conversione nella forma a.[5]
Regolazione allosterica di PP1
L’attività di PP1 è modulata anche allostericamente dal glucosio 6-fosfato, che attiva l’enzima quando la carica energetica cellulare è bassa.[21]
Glicogeno fosforilasi del fegato
Nel fegato, la regolazione allosterica della glicogeno fosforilasi avviene attraverso meccanismi distinti da quelli presenti nel muscolo.
- La prima differenza riguarda la risposta all’AMP: la glicogeno fosforilasi b epatica non è attivata dall’AMP.
- La seconda differenza riguarda la glicogeno fosforilasi a, che è inibita dal glucosio. Il glucosio agisce come un inibitore competitivo, spostando l’equilibrio allosterico verso lo stato T inattivo della forma a.[4][24]
Nel fegato, lo scopo della glicogenolisi è quello di fornire glucosio agli altri tessuti quando la glicemia è bassa.
Quando la glicemia è tornata a valori normali, la concentrazione del monosaccaride nell’epatocita aumenta, e lo stesso si va a legare a un sito accessibile sulla glicogeno fosforilasi a. Questo legame induce un cambiamento conformazionale che espone i residui di serina fosforilati all’azione di PP1, che, defosforilando l’enzima, lo inattiva.
Quindi, il sito allosterico di legame per il glucosio della glicogeno fosforilasi epatica permette all’enzima epatico di agire come un sensore della glicemia, rispondendo in modo appropriato alle sue variazioni di concentrazione.
In definitiva, l’enzima epatico risponde solo al glucosio, non all’AMP, ossia, non alla carica energetica cellulare, il che è degno di nota perché gli acidi grassi, piuttosto che il glucosio, sono la principale fonte di energia per il fegato.[5]
Bibliografia
- ^ Patino S.C., Orrick J.A. Biochemistry – Glycogenolysis. [Updated 2024 Jan 27]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK549820/
- ^ Neoh G.K.S., Tan X., Chen S., Roura E., Dong X., Gilbert R.G. Glycogen metabolism and structure: a review. Carbohydr Polym 2024;346:122631. doi:10.1016/j.carbpol.2024.122631
- ^ Adeva-Andany M.M., González-Lucán M., Donapetry-García C., Fernández-Fernández C., Ameneiros-Rodríguez E. Glycogen metabolism in humans. BBA Clin 2016;27;5:85-100. doi:10.1016/j.bbacli.2016.02.001
- ^ a b c d e f g Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 8th Edition. W.H. Freeman and Company, 2021.
- ^ a b c d e f g h Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 4th Edition. St. Louis: Elsevier, 2018.
- ^ a b Berg J.M., Tymoczko J.L., Gregory J.G. Jr, Stryer L. Biochemistry. 9th Edition. W.H. Freeman and Company, 2019.
- ^ Janeček Š., Svensson B., MacGregor E.A. α-Amylase: an enzyme specificity found in various families of glycoside hydrolases. Cell Mol Life Sci 2014;71(7):1149-70. doi:10.1007/s00018-013-1388-z
- ^ a b c d Garrett R.H., Grisham C.M. Biochemistry. 7th Edition. Brooks/Cole, Cengage Learning, 2023.
- ^ Gillard B.K., Nelson T.E. Amylo-1,6-glucosidase/4-alpha-glucanotransferase: use of reversible substrate model inhibitors to study the binding and active sites of rabbit muscle debranching enzyme. Biochemistry 1977;16(18):3978-87. doi:10.1021/bi00637a007
- ^ Guan H., Chen H., Geng H., Ma R., Liu Z., Wang Y., Chen Y., Yan K. Molecular architecture and catalytic mechanism of human glycogen debranching enzyme. Nat Commun 2025;16(1):5962. doi:10.1038/s41467-025-61077-6
- ^ a b c d e Heilman D., Woski S., Voet D., Voet J.G., Pratt C.W. Fundamentals of biochemistry: life at the molecular level. 6th Edition. Wiley, 2023.
- ^ Brueckner F., Piscitelli C.L., Tsai C.J., Standfuss J., Deupi X., Schertler G.F. Structure of β-adrenergic receptors. Methods Enzymol 2013;520:117-51. doi:10.1016/B978-0-12-391861-1.00006-X
- ^ a b c Weis W.I., Kobilka B.K. The molecular basis of G protein-coupled receptor activation. Annu Rev Biochem 2018;87:897-919. doi:10.1146/annurev-biochem-060614-033910
- ^ Mozzarelli A.M., Simanshu D.K., Castel P. Functional and structural insights into RAS effector proteins. Mol Cell 2024;84(15):2807-2821. doi:10.1016/j.molcel.2024.06.027
- ^ Qi C., Sorrentino S., Medalia O., Korkhov V.M. The structure of a membrane adenylyl cyclase bound to an activated stimulatory G protein. Science 2019;364(6438):389-394. doi:10.1126/science.aav0778
- ^ Søberg K., Skålhegg B.S. The Molecular basis for specificity at the level of the protein kinase a catalytic subunit. Front Endocrinol (Lausanne) 2018;9:538. doi:10.3389/fendo.2018.00538
- ^ Wombacher H. Theophylline effect on the cyclic AMP degrading multienzyme sequence. Biochem Pharmacol 1982;31(21):3441-6. doi:10.1016/0006-2952(82)90624-4
- ^ Thompson J.A., Carlson G.M. The regulatory α and β subunits of phosphorylase kinase directly interact with its substrate, glycogen phosphorylase. Biochem Biophys Res Commun 2017;482(2):221-225. doi:10.1016/j.bbrc.2016.11.044
- ^ a b Migocka-Patrzałek M., Elias M. Muscle glycogen phosphorylase and its functional partners in health and disease. Cells 2021;10(4):883. doi:10.3390/cells10040883
- ^ Terrak M., Kerff F., Langsetmo K., Tao T., Dominguez R. Structural basis of protein phosphatase 1 regulation. Nature 2004;429(6993):780-4. doi:10.1038/nature02582
- ^ Peti W., Nairn A.C., Page R. Structural basis for protein phosphatase 1 regulation and specificity. FEBS J 2013;280(2):596-611. doi:10.1111/j.1742-4658.2012.08509.x
- ^ Brushia R.J., Walsh D.A. Phosphorylase kinase: the complexity of its regulation is reflected in the complexity of its structure. Front Biosci 1999;4:D618-41. doi:10.2741/brushia
- ^ Johnson L.N. Glycogen phosphorylase: control by phosphorylation and allosteric effectors. FASEB J 1992;6(6):2274-82. doi:10.1096/fasebj.6.6.1544539
- ^ Johnson L.N., Barford D. The effects of phosphorylation on the structure and function of proteins. Annu Rev Biophys Biomol Struct 1993;22:199-232. doi:10.1146/annurev.bb.22.060193.001215