La digestione delle proteine è il processo fisiologico attraverso il quale le proteine vengono scomposte in amminoacidi dall’azione di enzimi noti come proteasi. Questi enzimi sono sintetizzati e immagazzinati all’interno delle cellule in forma inattiva, nota come zimogeni o proenzimi, per impedire che digeriscano se stessi e le altre proteine cellulari. Vengono rilasciati e attivati solo durante la digestione.[1]
La cottura e la masticazione facilitano la digestione delle proteine, che avviene in due fasi: la prima nello stomaco e la seconda e principale nel duodeno.[2]
La digestione delle proteine serve principalmente a soddisfare il fabbisogno dell’organismo in amminoacidi essenziali che, come gli acidi grassi essenziali (molecole lipidiche che non possono essere sintetizzate dall’organismo), devono essere assunti con gli alimenti.[3]
In Sintesi: Punti Chiave
- Digestione delle proteine: processo biochimico di scomposizione delle proteine alimentari ed endogene negli amminoacidi costituenti.
- Fase gastrica: inizia nello stomaco grazie all’azione dell’acido cloridrico e della pepsina, che denaturano le proteine e avviano l’idrolisi dei legami peptidici.
- Fase duodenale: avviene attraverso una cascata di proteasi pancreatiche (attivate dalle loro forme zimogeniche inattive) e viene completata dall’azione delle amminopeptidasi e delle dipeptidasi nell’orletto a spazzola.
- Assorbimento e destino: gli amminoacidi, i dipeptidi e i tripeptidi rilasciati vengono assorbiti dagli enterociti. Gli amminoacidi liberi entrano quindi nella circolazione portale e vengono utilizzati per la riparazione dei tessuti, la crescita e le sintesi metaboliche.
Indice
- Enzimi digestivi: classificazione e origine
- Zimogeni, attivazione enzimatica e struttura proteica
- Ruolo della cottura e della masticazione
- Fase gastrica della digestione delle proteine
- Fase duodenale della digestione delle proteine
- Efficienza degli enzimi proteolitici
- Importanza della digestione delle proteine
- Fonti di proteine
- Bibliografia
Enzimi digestivi: classificazione e origine
La digestione delle proteine avviene attraverso l’idrolisi dei legami peptidici che uniscono i singoli amminoacidi all’interno della catena polipeptidica. Queste reazioni sono catalizzate da proteasi.[4]
Le proteasi digestive, specifiche per le catene laterali degli amminoacidi, sono idrolasi che possono essere suddivise in due classi principali:
- endopeptidasi, che idrolizzano i legami peptidici presenti all’interno della catena polipeptidica e sono prodotte dallo stomaco e dal pancreas esocrino;
- esopeptidasi, che possono essere ulteriormente suddivise in due gruppi:
- carbossipeptidasi, che rimuovono gli amminoacidi dall’estremità C-terminale e sono prodotte dal pancreas esocrino;
- amminopeptidasi, che agiscono sull’estremità N-terminale e sono prodotte dagli enterociti.[1]
| Sito di sintesi | Zimogeno | Enzima attivo |
|---|---|---|
| Stomaco | Pepsinogeno | Pepsina |
| Pancreas | Chimotripsinogeno | Chimotripsina |
| Pancreas | Tripsinogeno | Tripsina |
| Pancreas | Procarbossipeptidasi A e B | Carbossipeptidasi A e B |
| Pancreas | Proelastasi | Elastasi |
Questi enzimi sono sintetizzati e secreti in forma di zimogeni inattivi.[5]
Zimogeni, attivazione enzimatica e struttura proteica
All’interno della cellula, gli zimogeni sono immagazzinati in granuli legati alla membrana. Quando la cellula viene stimolata da un segnale specifico, la membrana del granulo si fonde con la membrana plasmatica e gli zimogeni vengono rilasciati per esocitosi.[1]
Le proteasi sono sintetizzate in forma inattiva per impedire che digeriscano se stesse e/o le proteine cellulari prima della secrezione. In questi precursori inattivi, il sito attivo dell’enzima è “mascherato”; solo dopo l’attivazione l’enzima può interagire con il suo substrato. L’attivazione deriva dalla scissione di uno o più legami peptidici specifici, catalizzata da un enzima specifico, che porta al rilascio di uno o più segmenti della catena polipeptidica. Questo processo consente all’enzima di assumere la sua conformazione tridimensionale attiva, in cui il sito attivo è esposto e correttamente configurato.[4][6]
L’accumulo di zimogeni all’interno dei granuli rappresenta un ulteriore meccanismo protettivo, poiché li isola dagli altri componenti cellulari.[5]
Ruolo della cottura e della masticazione
La maggior parte delle proteine nella loro conformazione nativa è resistenti all’azione delle proteasi. Questa resistenza è dovuta alla loro struttura secondaria e terziaria (nativa), che maschera molti legami peptidici dall’attacco enzimatico. Queste strutture sono stabilizzate da legami covalenti, come i ponti disolfuro tra i residui di cisteina, nonché da forze non covalenti, tra cui interazioni ioniche, legami idrogeno e forze di van der Waals.[5]
Per un’efficace digestione delle proteine, i legami peptidici devono quindi essere il più possibile accessibili alle proteasi. Ciò si ottiene all’esterno del corpo attraverso la cottura e all’interno attraverso l’ambiente acido dello stomaco.[2]
La cottura, se non eccessiva, facilita la digestione delle proteine.
Come avviene questo processo?
Al pari di tutte le molecole, le proteine non sono immobili ma vibrano continuamente. Con l’aumentare della temperatura, le proteine vibrano con maggiore ampiezza, finendo per rompere i legami non covalenti che aiutano a mantenere la loro struttura nativa. Di conseguenza, si verifica un cambiamento conformazionale, ovvero la proteina viene denaturata. Questo processo rende i legami peptidici interni più accessibili all’azione degli enzimi digestivi.[7]
La masticazione e l’insalivazione omogeneizzano e inumidiscono anche i componenti solidi del cibo, facilitandone la digestione.[8]
Fase gastrica della digestione delle proteine
La digestione delle proteine inizia nello stomaco, dove rappresenta una fase preparatoria per i processi che avvengono nel duodeno.[9]
La presenza di cibo nello stomaco stimola le cellule G nella mucosa dell’antro gastrico e del duodeno prossimale a sintetizzare e rilasciare nel flusso sanguigno l’ormone gastrina. L’ormone stimola le cellule parietali delle ghiandole gastriche, situate principalmente nel fondo e nel corpo dello stomaco, a secernere acido cloridrico (HCl) nel lume gastrico. Le cellule parietali producono anche il fattore intrinseco, una proteina che si lega alla vitamina B12, impedendone la degradazione e consentendone l’assorbimento.
Le ghiandole gastriche contengono anche:
- cellule mucose del collo, che producono muco;
- cellule principali, che secernono pepsinogeno.
Tutte queste sostanze, insieme ad altre come gli ioni di potassio e la lipasi gastrica, costituiscono il succo gastrico, che ha un pH compreso tra 1 e 2,5.[10]
A causa del suo basso pH, il succo gastrico esercita un effetto antisettico, uccidendo la maggior parte dei batteri e delle altre cellule estranee, e un effetto denaturante, poiché rompe i legami non covalenti che stabilizzano la struttura nativa delle proteine. Questa denaturazione facilita l’accesso delle proteasi digestive ai legami peptidici, in modo simile all’effetto del calore durante la cottura.[11]
Alcune proteine ricche di legami disolfuro, come le cheratine, sono resistenti alla denaturazione indotta dall’acido e sono quindi difficili da digerire. Al contrario, la maggior parte delle proteine globulari viene idrolizzata in grandi frammenti peptidici (o polipeptidi).[12]
Infine, il pH acido del succo gastrico converte il pepsinogeno, uno zimogeno, in pepsina, il primo enzima coinvolto nella digestione delle proteine.[13]
Pepsina
Esistono diversi isoenzimi del pepsinogeno, come il tipo I, sintetizzato dalle cellule principali nel corpo e nel fondo dello stomaco, e il tipo II, che viene prodotto in tutto l’organo. Tutti gli isoenzimi vengono convertiti nell’enzima attivo.[13]
L’attivazione avviene tramite autocatalisi a valori di pH inferiori a 5 attraverso un processo intramolecolare che comporta l’idrolisi di uno specifico legame peptidico e il rilascio di un piccolo peptide dall’estremità N-terminale dello zimogeno. Questo peptide rimane legato all’enzima e continua ad agire come inibitore fino a quando il pH non scende al di sotto di 2 o fino a quando non viene ulteriormente degradato dalla pepsina stessa. Di conseguenza, una volta che si è formata una certa quantità di pepsina, questa attiva rapidamente ulteriori molecole di pepsinogeno.[3]
La pepsina è un’endopeptidasi con un’attività ottimale a pH 1,6 e idrolizza circa il 10−20% delle proteine presenti in un pasto. Come molti enzimi digestivi, mostra un’ampia specificità di substrato e catalizza la scissione dei legami peptidici adiacenti ai residui amminoacidici come la leucina e gli amminoacidi aromatici fenilalanina, tirosina e triptofano. Ne risulta una miscela di peptidi relativamente grandi e una piccola quantità di amminoacidi liberi.[1]
L’importanza della pepsina non risiede tanto nel suo contributo diretto alla digestione delle proteine, che è modesto, quanto nella generazione di peptidi e amminoacidi che, a livello duodenale, stimolano la secrezione di colecistochinina (CCK) e quindi promuovono la fase duodenale−pancreatica della digestione delle proteine.[9]
Va inoltre notato che la digestione mediata dalla pepsina del collagene, una famiglia di proteine che circondano e tengono insieme le cellule muscolari, facilita l’accesso delle proteasi pancreatiche alle proteine alimentari intracellulari della carne.[14]
Fase duodenale della digestione delle proteine
Quando il contenuto gastrico entra nel duodeno, la sua acidità stimola le cellule S situate nella mucosa duodenale e nella parte prossimale del digiuno, il segmento successivo dell’intestino tenue, a sintetizzare e rilasciare nel flusso sanguigno l’ormone secretina.[9]
L’ormone induce la secrezione di un succo pancreatico alcalino ricco di ioni bicarbonato, ma relativamente povero di enzimi. Questo succo raggiunge il duodeno attraverso il dotto pancreatico, dove neutralizza l’acido cloridrico gastrico, portando il pH a valori compresi tra 6 e 7. La secretina stimola anche la secrezione biliare e inibisce il rilascio di gastrina.[15]
La presenza di amminoacidi nel duodeno stimola le cellule endocrine del duodeno e del digiuno a rilasciare nel flusso sanguigno colecistochinina.[5] Questo ormone, tra le altre funzioni, stimola il pancreas esocrino a secernere un succo ricco di enzimi presenti in forma di zimogeni, tra cui:
- tripsinogeno, chimotripsinogeno e proelastasi, endopeptidasi con una diversa specificità di substrato sia tra di loro che rispetto alla pepsina;
- procarbossipeptidasi A e B, esopeptidasi che rimuovono gli amminoacidi dall’estremità C-terminale dei peptidi.[3]
Va notato che le proteasi pancreatiche, a differenza della pepsina, mostrano un’attività ottimale a valori di pH compresi tra 7 e 8, corrispondenti a un ambiente neutro o leggermente alcalino. Pertanto, il duodeno fornisce un ambiente neutro adatto alla continuazione della digestione delle proteine.[1]
Poiché queste proteasi hanno specificità di substrato diverse, i peptidi generati da un enzima possono fungere da substrati per altri. Di conseguenza, le proteine parzialmente digerite che entrano nel duodeno vengono efficacemente idrolizzate in amminoacidi liberi e peptidi di 2−8 residui amminoacidici.[12]
Sebbene non siano direttamente coinvolti nella degradazione delle proteine, nel succo pancreatico sono presenti anche α-amilasi, lipasi e nucleasi.[3]
Attivazione degli zimogeni pancreatici
Il primo e fondamentale passo nell’attivazione degli zimogeni pancreatici è la conversione del tripsinogeno in tripsina da parte dell’enteropeptidasi, nota anche come enterochinasi. Questa endopeptidasi è espressa dagli enterociti duodenali e coordinata funzionalmente con la secrezione pancreatica mediata dal CCK.[9] L’enteropeptidasi catalizza la scissione di uno specifico legame peptidico tra lisina-6 e isoleucina-7 (nella sequenza umana) nel tripsinogeno, con conseguente rilascio di un esapeptide. Questa scissione induce un riassetto conformazionale della proteina che porta alla sua attivazione, ovvero alla formazione della tripsina.[12]
La tripsina attiva altri zimogeni pancreatici, tra cui il chimotripsinogeno, la proelastasi e le procarbossipeptidasi A e B, nonché ulteriori molecole di tripsinogeno attraverso l’autocatalisi. L’enzima scinde anche i legami peptidici adiacenti a residui di lisina e arginina nelle proteine alimentari.[16]
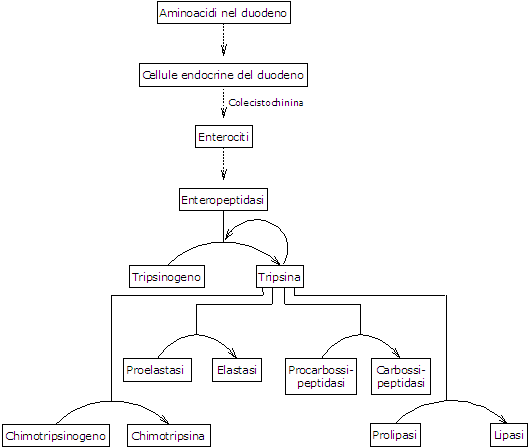
Man mano che gli zimogeni pancreatici si attivano, la capacità di digestione delle proteine del duodeno aumenta progressivamente, un processo avviato da una quantità relativamente piccola di enteropeptidasi.[1]
Inibitore pancreatico della tripsina secretoria
Un ulteriore meccanismo di protezione contro l’attività della tripsina intrapancreatica è la sintesi di un inibitore noto come inibitore pancreatico della tripsina secretoria (PSTI).[17]
Questa molecola, presente nei granuli di zimogeni pancreatici, si lega saldamente al sito attivo della tripsina, inattivandola. In questo modo, qualsiasi tripsina generata dall’attivazione prematura del tripsinogeno viene bloccata, impedendo una cascata in cui poche molecole attivate attiverebbero tutti gli zimogeni pancreatici.[12]
Nelle piante esistono molte molecole con attività inibitoria simile. Un esempio è l’inibitore di Kunitz, una proteina presente principalmente nei semi di soia, che forma un complesso altamente stabile con il sito attivo della tripsina.[18][19]
Attivazione del chimotripsinogeno
La conversione del chimotripsinogeno in chimotripsina avviene attraverso diverse fasi che coinvolgono sia la tripsina che la stessa chimotripsina attivata. Nella fase iniziale, la tripsina scinde un legame peptidico specifico (arginina-15−isoleucina-16), convertendo il chimotripsinogeno in π-chimotripsina, che è enzimaticamente attiva. Successivamente, attraverso l’autocatalisi, la π-chimotripsina rilascia due dipeptidi per formare la δ-chimotripsina, un intermedio più stabile. La δ-chimotripsina subisce quindi due riarrangiamenti conformazionali: il primo produce la κ-chimotripsina e il secondo la α-chimotripsina, la forma attiva finale dell’enzima.
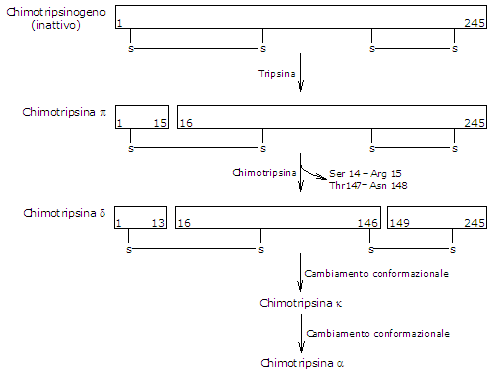
La chimotripsina idrolizza i legami peptidici adiacenti ai residui di fenilalanina, triptofano, metionina, tirosina e leucina.[12]
Attivazione della proelastasi
La proelastasi viene convertita in elastasi attraverso la rimozione di un piccolo peptide dalla sua estremità N-terminale. L’elastasi, che è meno specifica per il substrato rispetto ad altre proteasi digestive, scinde i legami peptidici adiacenti ad amminoacidi quali glicina, alanina e serina.[4]
Attivazione della procarbossipeptidasi
La procarbossipeptidasi A viene attivata in carbossipeptidasi A, che rimuove gli amminoacidi con catene laterali ramificate o aromatiche, come la fenilalanina e la valina, dall’estremità C-terminale dei peptidi.
La procarbossipeptidasi B viene attivata in carbossipeptidasi B, che è specifica per gli amminoacidi con catene laterali basiche, come la lisina e l’arginina.[5]
Peptidasi dell’orletto a spazzola
I peptidi di 2−8 residui amminoacidici risultanti dall’attività delle proteasi digestive sono quindi substrati per le amminopeptidasi situate nell’orletto a spazzola degli enterociti; sono presenti anche dipeptidasi.[20]
Gli amminoacidi rilasciati, insieme ai dipeptidi e ai tripeptidi, vengono assorbiti dagli enterociti. I dipeptidi e i tripeptidi vengono idrolizzati nei loro amminoacidi costituenti all’interno degli enterociti dalle peptidasi citosoliche, il che spiega perché la circolazione portale contiene quasi esclusivamente amminoacidi liberi.[9]
Va notato che le proteasi stesse vengono infine degradate, terminando così il processo digestivo.[3]
Efficienza degli enzimi proteolitici
L’efficienza degli enzimi proteolitici intestinali è evidente dal seguente confronto. In vitro, l’idrolisi completa di una proteina nei suoi amminoacidi costituenti richiede l’uso di un acido forte (HCl 6M) e il riscaldamento prolungato del campione a 105 °C. Nel tratto gastrointestinale, lo stesso risultato si ottiene in poche ore, prima nell’ambiente acido dello stomaco e poi nelle condizioni leggermente alcaline del duodeno, a 37 °C.[21]
Importanza della digestione delle proteine
Il corpo ha bisogno di proteine, o più precisamente degli amminoacidi che le compongono, principalmente perché gli amminoacidi essenziali non possono essere sintetizzati endogenamente e devono quindi essere assunti con la dieta.[5]
Gli amminoacidi rilasciati sono essenziali per il mantenimento, la crescita e la riparazione dei tessuti corporei, mentre il loro contributo come fonte di energia è, nella maggior parte dei casi, molto inferiore a quello dei carboidrati e degli acidi grassi.[9]
L’apporto proteico giornaliero raccomandato per un adulto sano è di circa 0,9 g/kg di peso corporeo; quindi, per un individuo di 70 kg, ciò corrisponde a circa 63 g al giorno. Negli adulti di età superiore ai 60 anni, si raccomanda generalmente un apporto più elevato per contrastare la perdita di massa muscolare legata all’età, con valori suggeriti di almeno 1,0 g/kg di peso corporeo.[22]
La digestione delle proteine è importante non solo per l’ospite, ma anche per il microbiota intestinale. La perdita giornaliera di azoto attraverso le feci è di circa 1,6 g, corrispondente a circa 10 g di proteine. La maggior parte di questo azoto viene utilizzata dai batteri del colon per la crescita e viene quindi rilasciato nelle feci come parte della biomassa batterica.[23]
Fonti di proteine
La digestione delle proteine non riguarda solo le proteine alimentari, ma anche quelle endogene. Ogni giorno, 50–100 g di proteine endogene entrano nel lume del tratto gastrointestinale a seguito delle secrezioni digestive e del ricambio cellulare. Queste proteine derivano da:
- saliva;
- succo gastrico;
- enzimi pancreatici e altre secrezioni;
- cellule epiteliali intestinali desquamate;
- proteine (come l’albumina) che entrano nel lume intestinale dal flusso sanguigno.[1]
Bibliografia
- ^ a b c d e f g Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 4th Edition. St. Louis: Elsevier, 2018.
- ^ a b Sensoy I. A review on the food digestion in the digestive tract and the used in vitro models. Curr Res Food Sci 2021;4:308-319. doi:10.1016/j.crfs.2021.04.004
- ^ a b c d e Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 8th Edition. W.H. Freeman and Company, 2021.
- ^ a b c Garrett R.H., Grisham C.M. Biochemistry. 7th Edition. Cengage Learning, 2023.
- ^ a b c d e Heilman D., Woski S., Voet D., Voet J.G., Pratt C.W. Fundamentals of biochemistry: life at the molecular level. 6th Edition. Wiley, 2023.
- ^ Gaisano H.Y., Gorelick F.S. New insights into the mechanisms of pancreatitis. Gastroenterology 2009;136(7):2040-4. doi:10.1053/j.gastro.2009.04.023
- ^ Alberts B., Johnson A., Lewis J., Morgan D., Raff M., Roberts K., Walter P. Molecular Biology of the Cell. 7th Edition. Garland Science, Taylor & Francis Group, 2022.
- ^ Mosca A.C., Chen J. Food oral management: physiology and objective assessment. Curr Opin Food Sci 2016;9:11-20. doi:10.1016/j.cofs.2016.03.003
- ^ a b c d e f Guyton A.C., Hall J.E. Textbook of Medical Physiology. 14th Edition. Philadelphia: Elsevier, 2021.
- ^ Prosapio J.G., Sankar P., Jialal I. Physiology, Gastrin. [Updated 2023 Apr 6]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/sites/books/NBK534822/
- ^ Martinsen T.C., Fossmark R., Waldum H.L. The phylogeny and biological function of gastric juice-microbiological consequences of removing gastric acid. Int J Mol Sci 2019;20(23):6031. doi:10.3390/ijms20236031
- ^ a b c d e Berg J.M., Tymoczko J.L., Gregory J.G. Jr, Stryer L. Biochemistry. 9th Edition. W.H. Freeman and Company, 2019.
- ^ a b Heda R., Toro F., Tombazzi C.R. Physiology, Pepsin. [Updated 2023 May 1]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK537005/
- ^ Yang M., Yang Z., Everett D. W., Gilbert E. P., Singh H., Ye A. Digestion of food proteins: the role of pepsin. Crit Rev Food Sci Nutr 2025;65(30):6919-6940. doi:10.1080/10408398.2025.2453096
- ^ Afroze S., Meng F., Jensen K., et al. The physiological roles of secretin and its receptor. Ann Transl Med 2013;1(3):29. doi:10.3978/j.issn.2305-5839.2012.12.01
- ^ Freiburghaus A.U., Roduner J., Hadorn H.B. Activation of human pancreatic proteolytic enzymes: the role of enteropeptidase and trypsin. JPGN Rep 2021;2(4):e138. doi:10.1097/PG9.0000000000000138
- ^ Wang G.P., Xu C.S. Pancreatic secretory trypsin inhibitor: More than a trypsin inhibitor. World J Gastrointest Pathophysiol 2010;1(2):85-90. doi:10.4291/wjgp.v1.i2.85
- ^ Li J., Brader G., Palva E.T. Kunitz trypsin inhibitor: an antagonist of cell death triggered by phytopathogens and fumonisin b1 in Arabidopsis. Mol Plant 2008;1(3):482-95. doi:10.1093/mp/ssn013
- ^ Deetanya P., Limsardsanakij K., Sabat G., Pattaradilokrat S., Chaisuekul C., Wangkanont K. Kunitz-type trypsin inhibitor from durian (Durio zibethinus) employs a distinct loop for trypsin inhibition. Protein Sci 2024;33(12):e5230. doi:10.1002/pro.5230
- ^ Anandharamakrishnan C., Moses J.A., Priyanka S. Small intestine, digestion, and nutrient absorption. In: Food digestion and absorption: its role in food product development. Food chemistry, function and analysis. Vol. 42. Cambridge: Royal Society of Chemistry; 2023. doi:10.1039/BK9781839162428-00106
- ^ Santos-Sánchez G., Miralles B., Brodkorb A., Dupont D., Egger L., Recio I. Current advances for in vitro protein digestibility. Front Nutr 2024;11:1404538. doi:10.3389/fnut.2024.1404538
- ^ Nunes E.A., Colenso-Semple L., McKellar S.R., et al. Systematic review and meta-analysis of protein intake to support muscle mass and function in healthy adults. J Cachexia Sarcopenia Muscle 2022;13(2):795-810. doi:10.1002/jcsm.12922
- ^ Bartlett A., Kleiner M. Dietary protein and the intestinal microbiota: an understudied relationship. iScience 2022;25(11):105313. doi:10.1016/j.isci.2022.105313